
 |
| В. Т. Чумак |
Система надзора за использованием ЛС в Украине создана, ее структура оптимизирована (рис. 1), и она работает! Это отмечали Виктор Чумак, директор ГФЦ МЗ Украины, Алексей Викторов, профессор, консультант Управления пострегистрационного надзора ГФЦ МЗ Украины (далее — Управление), Елена Матвеева, начальник Управления, другие участники конференции.
Знаменательно, что сейчас, когда сбор и анализ сообщений от врачей и производителей уже налажены, мы проходим новый этап становления системы, а именно — внедрение мониторинга безопасности ЛС как составляющей формулярной системы, — подчеркнул в своем докладе главный идеолог отечественного фармаконадзора, один из его основоположников А. Викторов.
 |
| А. П. Викторов |
Важно, что в стране начиная с 1996 г. создано правовое поле для работы фармаконадзора, при этом, по словам профессора, за основу взят международный опыт, но, кроме этого, учтены особенности отечественного законодательства. Краеугольный камень нормативно-правовой базы по фармаконадзору — требования Всемирной организации здравоохранения (ВОЗ) к ЛС, его эффективности, безопасности и качеству, — отметил А. Викторов. Основной критерий, применяемый в этой сфере, — соотношение риск/польза, на котором базируется рациональная фармакотерапия как составляющая доказательной медицины.
 |
| Е. В. Матвеева |
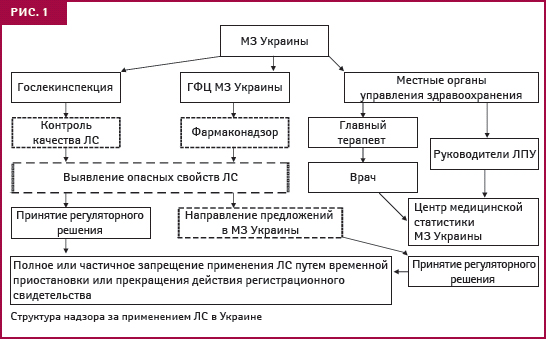
Надзор за применением ЛС в Украине, как отметил В. Чумак, осуществляют Государственная инспекция по контролю качества лекарственных средств (далее — Гослекинспекция), ГФЦ МЗ Украины и местные органы управления здравоохранением (см. рис. 1). На конференции много говорили о необходимости внедрения системы мер, обеспечивающих взаимодействие Гослекинспекции и ГФЦ МЗ Украины (об этом — в следующих публикациях).
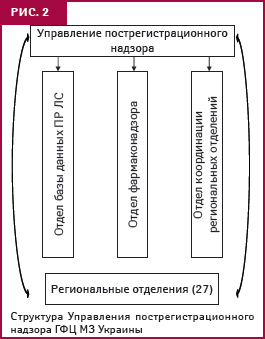
Координатором осуществления фармаконадзора в Украине является ГФЦ. Его структурное подразделение — Управление пострегистрационного надзора, получает, обрабатывает и анализирует информацию о побочных реакциях (рис. 2). В последние годы усовершенствована его структура, что позволило оптимизировать работу и расширить возможности профессионального совершенствования сотрудников, отметил А. Викторов. Сегодня 27 региональных отделений хорошо укомплектованы кадрами (количество сотрудников составляет 77, из них 39% имеют ученую степень), в том числе внештатными специалистами, среди которых главные специалисты региональных управлений здравоохранения по специальности «терапия». Особенно активно сообщения о побочных реакциях ЛС поступают в отделения АР Крым, Харьковского Луганского, Днепропетровского, Винницкого регионов, городов Киев и Севастополь. Схему получения информации о побочных реакциях ЛС в Украине представила Е. Матвеева (рис. 3).
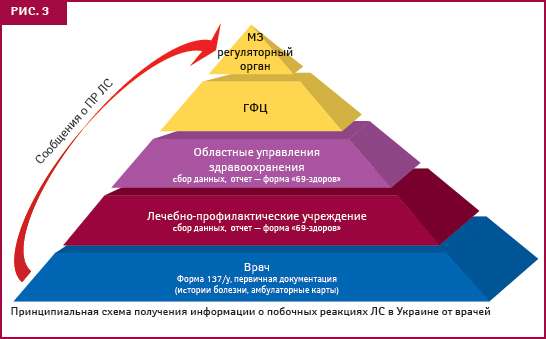
В случае необходимости, например при возникновении чрезвычайных ситуаций или при перерегистрации ЛС, Управление дает рекомендации, на которые опирается в своих решениях МЗ Украины.
Сообщения о побочных реакциях сегодня предоставляют только примерно 40% лечебно- профилактических учреждений (ЛПУ). Но раньше абсурдная ситуация, когда на нескольких сотнях коек за весь год не регистрировали ни одной побочной реакции, была еще более распространена. С 2001 г. МЗ требует раз в год подавать форму государственной отчетности «69- здоров», где отображают все побочные реакции ЛС, отмеченные в ЛПУ региона. Однако руководящие структуры здравоохранения недооценивают важность этой отчетности в отношении оценки побочных реакций ЛС.
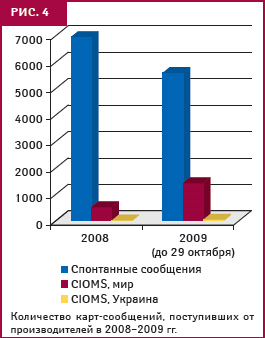
Между тем, ежегодно поступает около 5–7 тыс. спонтанных сообщений о подозреваемых побочных реакциях ЛС (рис. 4), и база данных Управления включает сегодня около 40 тыс. сообщений с установленной причинно-следственной связью, — это неплохой показатель, отметил А. Викторов. Среди ЛПУ, предоставляющих информацию, преобладают центральные районные больницы (ЦРБ) — 30%, городские клинические больницы (ГКБ) — 19% и поликлиники для взрослых — 28,4% (таблица). Особенно настораживает, как подчеркнул А. Викторов, очень низкая активность роддомов и педиатрических отделений. То же касается госпиталей, хотя подавать сообщения о побочных реакциях должны все учреждения здравоохранения независимо от подчинения и формы собственности.
| Таблица | Участие ЛПУ в репортировании о случаях побочных реакций ЛС при их медицинском использовании |
| ЛПУ | Количество, % |
| ЦРБ | 30,1 |
| ГКБ | 18,9 |
| Поликлиники (не городские) | 28,4 |
| Городские поликлиники | 13,6 |
| Диспансеры | 7,8 |
| Областные клинические больницы | 5,3 |
| Станции скорой медицинской помощи | 2,1 |
| Детские поликлиники | 1,8 |
| Детские больницы | 1,6 |
| Центры СПИД | 1,6 |
| Госпитали | 1,3 |
| Амбулатории | 0,7 |
| Больницы скорой помощи | 0,6 |
С производителями, отметил А. Викторов, ведется четкая планомерная работа. Так, в процессе подготовки новой редакции Закона Украины «О лекарственных средствах» достигнуто согласие относительно ведущей роли производителя в осуществлении фармаконадзора. Кроме того:
- во всех компаниях и на производстве назначены лица, ответственные за осуществление фармаконадзора;
- регулярно проводятся тренинги сотрудников по вопросам фармаконадзора;
- все владельцы регистрационных свидетельств/производители предоставляют периодически обновляемые отчеты о безопасности (periodic safety update report — PSUR) в составе перерегистрационных материалов;
- значительное количество компаний регулярно, в соответствии с действующим законодательством, предоставляют сообщения по форме, разработанной Советом международных медицинских научных организаций (Council of international organizations of medical sciences — CIOMS).
Активность производителей будет значительно выше после включения раздела «Фармакологический надзор» в Закон Украины «О лекарственных средствах».
Совместно с производителями, отметил А. Викторов, проводится усовершенствование нормативной базы, методических рекомендаций и публикаций по вопросам фармаконадзора. Постоянно проводятся семинары, тренинги, индивидуальные консультации для сотрудников фармацевтических компаний (ежегодно — не менее 400).
Пожалуй, самая интересная инициатива со стороны производителей — изучение профиля безопасности препаратов при их медицинском применении, которое охватило уже несколько десятков тысяч пациентов. А. Викторов привел пример исследования нескольких препаратов для лечения заболеваний сердечно- сосудистой системы, которые недавно закончила компания «Фармак». Их участниками стали 11 тыс. пациентов — еще 10 лет тому назад о подобном и помыслить было страшно, — признался профессор.
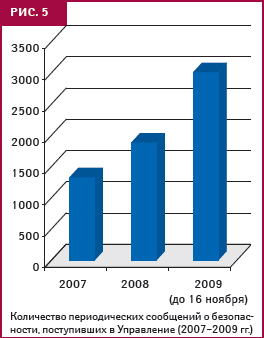 Одним из чрезвычайно важных направлений работы Управления является проведение специализированной экспертной оценки PSUR. В 2007 г. производители предоставили 1334, в 2008 г. — 1891, а в І кв. 2009 г. — 916 PSUR (рис. 5). Хотя регулярное поступление PSUR налажено, существует ряд проблем:
Одним из чрезвычайно важных направлений работы Управления является проведение специализированной экспертной оценки PSUR. В 2007 г. производители предоставили 1334, в 2008 г. — 1891, а в І кв. 2009 г. — 916 PSUR (рис. 5). Хотя регулярное поступление PSUR налажено, существует ряд проблем:
- побочные реакции, оцененные как достоверные, должны быть своевременно, по мере выявления отражены в краткой характеристике (Summary of Product Characteristics — SmPC) и других документах компании;
- производители генерических ЛС должны устранить несоответствия в информации относительно безопасности своих препаратов таковой у оригинальных, отразить это в SmPC, PSUR и других документах компании;
- большинство побочных реакций, представленных в PSUR относительно ЛС зарубежного производства, произошли не в нашей стране, поэтому сбор информации о таковых представительствами зарубежных производителей в Украине требует усовершенствования;
- часто возникает ситуация, когда в какой-либо стране в информацию относительно безопасности вносят изменения и дополнения. Сделать то же самое в Украине производитель иногда отказывается. Во избежание возникновения такой проблемы необходимо обеспечить централизованное обновление информации относительно безопасности препарата во всех документах компании.
За последние год-два в Украине принят ряд нормативно-правовых документов, на основании которых будет осуществляться мониторинг эффективности и безопасности ЛС в стационарах — ретроспективный и проспективный анализ и сбор демографических, социальных и медицинских данных всех поступающих пациентов с целью активного выявления всех побочных реакций.
Мониторинг предусматривает два этапа экспертизы фармакотерапевтических назначений (первичная — не позднее 48 ч с момента госпитализации, и заключительная — не позднее 48 ч с момента выписки), что подтверждается записью в медицинской карте стационарного больного. Это позволит адекватно и рационально оценить все ЛС, которые применяли в стационаре, а также принять адекватные решения относительно дальнейшего применения тех или иных ЛС.
Важно то, что в ходе мониторинга получают информацию обо всех ЛС — как вошедших, так и не вошедших в локальный формуляр. Мониторинг стационаров даст возможность обновлять локальный формуляр на объективной основе. То есть сегодня начинается процесс передачи рекомендаций относительно рационального применения ЛС «снизу вверх», другими словами — от звена практического здравоохранения. Пилотное исследование «Мониторинг безопасности и эффективности ЛС» уже проводится в Житомирской обл. (об этом — в следующих публикациях).
Отдельного внимания заслуживает также журнал «Рациональная фармакотерапия», в котором публикуют отечественные и мировые данные по безопасности и эффективности ЛС.
Причинами недостаточной активности информирования о побочных реакциях ЛС А. Викторов назвал прежде всего дефекты образования и опасения по поводу возможных административных последствий и ответственности в случае необоснованной терапии ЛС. Необходимо уделять больше внимания преподаванию клинической фармакологии, а также вопросам побочных реакций и фармаконадзора в вузах. В связи с этим А. Викторов обратил внимание, в частности, на опыт Российской Федерации, где курсу клинической фармакологии в подготовке врачей отведено в общей сложности 200 ч (начиная с 1987/1988 учебного года), тогда как в Украине — 32 ч.
Вот некоторые из заданий на будущее, предложенных, без преувеличения, корифеем фармаконадзора нашей страны:
- четкое определение роли клинического провизора в учреждениях здравоохранения и организация предаттестационных циклов для этих специалистов;
- внедрение метода мониторинга стационаров в отношении безопасности и эффективности ЛС на государственном уровне;
- внедрение формулярной системы;
- создание call-центра на межведомственном уровне (ассоциации производителей, Управления, Департамента регуляторной политики в сфере обращения ЛС и изделий медицинского назначения, Гослекинспекции, общественных организаций);
- разработка и внедрение широкого комплекса мер взаимодействия системы фармаконадзора и Гослекинспекции;
- активизация сотрудничества с профессиональными ассоциациями, научными врачебными сообществами, ведущими клиническими центрами и организациями АМН и МЗ Украины;
- осуществление и проведение различных видов анализа по рациональному использованию бюджетных средств, оценки фармакотерапии и качества оказания медицинской помощи.
Закон Украины «О лекарственных средствах», 1996 г., с изменениями и дополнениями 1998 г.
Приказ МЗ Украины от 27.12.2006 г. № 898 «Об утверждении Порядка осуществления фармаконадзора за побочными реакциями лекарственных средств, разрешенных для медицинского применения»
Приказ МЗ Украины от 24.07.2009 г. № 531 «Об утверждении Порядка осуществления мониторинга безопасности и эффективности в стационарах учреждений здравоохранения»
Приказ МЗ Украины от 01.09.2009 г. № 654 «Об утверждении Плана мер улучшения осуществления пострегистрационного надзора за безопасностью и эффективностью лекарственных средств и мониторинга безопасности и эффективности лекарственных средств в учреждениях здравоохранения»
Вторая научно-практическая конференция с международным участием «Безопасность лекарств: от разработки до медицинского применения», которая состоялась 3–4 декабря 2009 г. в Киеве, была организована МЗ Украины, АМН Украины, ГП «Государственный фармакологический центр» (ГФЦ) МЗ Украины. Ее проведение обусловлено необходимостью обсуждения актуальных вопросов методологии, организации и осуществления надзора за безопасностью лекарственных средств в процессе их разработки и медицинского применения в Украине, проведения анализа рационального использования бюджетных средств, качества оказываемой фармакотерапии, фармакоэкономики и фармакоэпидемиологии, оценки значимости составляющих формулярной системы и подходов к ее внедрению.
Программа конференции включала пленарное, секционные заседания, круглый стол. В рамках мероприятия состоялся обучающий семинар «Мониторинг использования лекарственных средств».
В работе конференции приняли участие представители ВОЗ, сотрудники регуляторных органов стран СНГ (Казахстана, Кыргызстана, России, Узбекистана) и Украины, представители практического здравоохранения, провизоры, руководители органов управления здравоохранением, ведущие ученые научно- исследовательских институтов, преподаватели медицинских и фармацевтических высших учебных заведений, представители ассоциаций производителей лекарственных средств, представители/производители лекарственных средств, в том числе из Германии, Франции, России. Общее количество участников конференции составило 418 человек.
На форуме обсуждались различные организационные и методические проблемы, связанные с безопасностью лекарств, состоянием и перспективами системы фармаконадзора, внедрения формулярной системы, а именно: роль регуляторных органов, производителей лекарственных средств и врачей в осуществлении контроля за безопасностью лекарств, вопросы своевременности принятия соответствующих регуляторных решений, обучения врачей и провизоров, подготовки специалистов в сфере фармаконадзора; а также вопросы составляющих и внедрения формулярной системы. Был представлен глубокий научный анализ особенностей развития и течения побочных реакций лекарственных средств, рассматривались методы изучения, профилактики, лечения побочных реакций лекарств, их фармакоэкономической оценки.
В ходе конференции обсуждались вопросы гармонизации взаимодействия регуляторных органов и отраслевых объединений, инспектирования системы фармаконадзора на локальном и государственном уровнях, осуществления сбора информации методом мониторинга стационаров по вопросам эффективности и безопасности лекарственных средств, внедрения формулярной системы.
Вторая научно-практическая конференция «Безопасность лекарств: от разработки до медицинского применения» констатирует, что МЗ Украины проведена большая работа в осуществлении надзора за безопасностью лекарственных средств на этапах разработки и широкого медицинского применения.
В настоящее время в Украине освоена и внедрена система спонтанных сообщений, налажена активная методическая и организационная деятельность Управления послерегистрационного надзора и региональных отделений ГФЦ МЗ Украины по вопросам фармаконадзора; сведения о побочных реакциях лекарственных средств включены в государственную медицинскую статистическую отчетность, проводятся исследования профиля безопасности лекарственных средств в пострегистрационный период; разработаны учебные планы и программы пред- и постдипломной подготовки врачей и провизоров по вопросам контроля побочных реакций лекарственных средств, налажены международные связи. Основой осуществления фармакологического надзора в Украине стали Директива Европейского парламента и Совета ЕС от 06.11.2001 г. № 2001/83 ЕС, постановление Совета ЕС от 22.07.1993 г. № 2309/93, а также Правила ЕС в отношении фармаконадзора за лекарственными препаратами для человека и для применения в ветеринарии (Volume 9 — Pharmacovigilance Medicinal Products for Human and Veterinary use), разработанные Международной конференцией по гармонизации (International Conference on Harmonisation — ICН) и принятые в Европейском Союзе, которые были представлены в Украине в книге «Фармацевтический сектор: фармаконадзор за лекарственными препаратами для человека»/Под ред. А.В. Стефанова (пред. редкол.), Т.А. Бухтиаровой, В.И. Мальцева, В.Г. Варченко, А.П. Викторова; авт.-сост.: Н.А. Ляпунов, Л.И. Ковтун, Е.П. Безуглая и др. — К.: МОРИОН, 2003. — 216 с.
Несмотря на наличие достижений в области организации и осуществления фармаконадзора в Украине, остается ряд проблем, подходы к решению которых четко определены в Дорожной карте МЗ Украины в фармацевтическом секторе (2008–2011 гг.):
I. Законодательные:
- необходимость принятия новой редакции Закона Украины «О лекарственных средствах» с учетом требований к контролю за безопасностью лекарственных средств;
- наличие соответствующей законодательной базы для медицинского страхования.
II. В сфере здравоохранения:
- внедрение формулярной системы;
- утверждение обоснованных стандартов, протоколов лечения, включая фармакотерапию;
- подготовка высококвалифицированных кадров для системы контроля за безопасностью лекарственных средств: для производителя (клинических фармацевтов), здравоохранения и регуляторных органов (по опыту зарубежных стран — врачей — клинических фармакологов);
- создание условий и внедрение системы мониторинга побочных реакций (овладение методами проведения фармакоэкономических, фармакоэпидемиологических исследований).
III. В фармацевтическом секторе:
- обязательное активное участие производителей лекарственных средств в надзоре за их безопасностью;
- совершенствование организационно-методической помощи регуляторной системы производителям лекарственных средств в создании соответствующей инфраструктуры;
- дальнейшая оптимизация взаимодействия системы контроля качества лекарственных средств и фармаконадзора;
- активное привлечение к осуществлению контроля за безопасностью лекарственных средств как источника информации сети аптечных учреждений (независимо от форм собственности).
В связи с изложенным выше Вторая научно-практическая конференция констатирует и предлагает:
1. Считать целесообразным проведение третьей конференции по безопасности применения лекарственных средств в 2012 г. (дата проведения конференции может быть пересмотрена и перенесена на 2013 г. в зависимости от экономической ситуации в стране).
2. Внести предложение о включении в Реестр съездов, конгрессов, симпозиумов и научно-практических конференций МЗ Украины и АМН Украины, запланированных на 2012 г., Третьей научно-практической конференции «Безопасность лекарственных средств: от разработки до медицинского применения».
3. Рекомендовать ГФЦ МЗ Украины совместно с МЗ Украины, ассоциациями производителей лекарственных средств, тренинговыми центрами способствовать организации и проведению обучающих семинаров и школ по вопросам безопасности лекарств для врачей, провизоров, фармацевтов, студентов медицинских и фармацевтических вузов, научных работников, производителей лекарственных средств, учитывая международный и собственный опыт в сфере фармаконадзора. Способствовать изданию руководств, методических рекомендаций, нормативных документов, связанных с вопросами безопасности лекарственных средств, для расширения и углубления знаний и реализации задач, стоящих перед участниками фармакологического надзора.
4. Опубликовать резолюцию конференции в журналах «Вісник фармакології та фармації», «Український медичний часопис», «Рациональная фармакотерапия», «Провизор», газетах «Еженедельник АПТЕКА», «Новости медицины и фармации», «Здоров’я України», «Ваше здоров’я», а также в специализированных медицинских изданиях, разместить ее на официальном сайте ГФЦ МЗ Украины.
5. МЗ Украины и АМН Украины при проведении ежегодных профильных научных форумов включать в их программу вопросы безопасности использования лекарственных средств.
6. Считать целесообразным координировать осуществление фармаконадзора в Украине со стандартами Европейского Союза, в том числе с использованием технической, организационной и методической помощи ЕС, ЕМЕА и ВОЗ.
7. ГФЦ МЗ Украины под руководством МЗ Украины разработать конкретный план мероприятий, который бы донес информацию о мониторинге стационаров по вопросам эффективности и безопасности лекарственных средств, формулярной системе до каждого учреждения здравоохранения и способствовал их внедрению в масштабах страны.
8. В номенклатуру специальностей внести специальность «клинический фармаколог».

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим