R&D-разработка лекарственных средств является не только длительным и финансово затратным процессом, который может позволить себе далеко не каждая фармацевтическая компания, но и процессом, продуктивность которого в последние годы ставится под вопрос. Каковы будут перспективы нового лекарственного средства на рынке после лонча? Стоит ли овчинка выделки? Фармацевтическим компаниям остается лишь надеяться, что лонч нового препарата будет удачным и принесет значительную прибыль.
По данным аналитической компании «EvaluatePharma», анализ терапевтических классов препаратов и кандидатов в препараты, лонч которых планируется в 2014 г., свидетельствует, что наибольший сегмент составляют препараты для лечения сахарного диабета (рисунок).
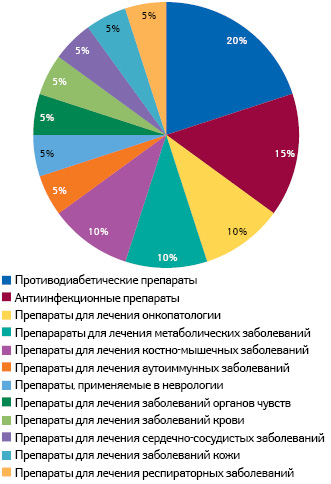
Однако, согласно прогнозам аналитической компании «EvaluatePharma», только 2 препарата и 1 кандидат в препараты из топ-10, намеченных к запуску в 2014 г., добьются статуса блокбастеров к 2018 г. (таблица).
| Таблица | Топ-10 самых успешных лончей, ожидаемых в 2014 г. |
| № | Препарат/кандидат в препараты | Основное показание к применению | Компания | Дата одобрения | Прогнозируемый объем продаж в США, млрд дол. | ||
| FDA | EMA | 2014 г. | 2018 г. | ||||
| 1 | Anoro Ellipta | Хроническая обструктивная болезнь легких | GlaxoSmithKline и Theravance | 18 декабря 2013 г. | – | 0,23 | 1,74 |
| 2 | Brintellix | Депрессия | Takeda Pharmaceutical и Lundbeck | 30 сентября 2013 г. | 18 декабря 2013 г. | 0,27 | 1,44 |
| 3 | Апремиласт | Псориатический артрит | Celgene | – | – | 0,09 | 1,22 |
| 4 | RLX030 (cерелаксин) | Острая сердечная недостаточность | Novartis Pharmaceuticals | – | – | 0,1 | 0,9 |
| 5 | Дулаглутид | Сахарный диабет II типа | Eli Lilly | – | – | 0,1 | 0,84 |
| 6 | Эмпаглифлозин | Сахарный диабет II типа | Boehringer Ingelheim и Eli Lilly | – | – | 0,09 | 0,77 |
| 7 | Афрезза | Сахарный диабет I и II типа | MannKind | – | – | 0,05 | 0,73 |
| 8 | Элоктат | Гемофилия, тип А | Biogen Idec | – | – | 0,04 | 0,69 |
| 9 | IMC-1121B (рамуцирумаб) | Рак желудка | Eli Lilly | – | – | 0,04 | 0,68 |
| 10 | LY2963016 | Сахарный диабет I и II типа | Eli Lilly и «Boehringer Ingelheim» | – | – | 0,01 | 0,65 |
Впрочем, ситуация может измениться, если в 2014 г. получат одобрение и выйдут на рынок кандидаты в препараты ниволумаб компании «Bristol-Myers Squibb», показанный для терапии распространенной меланомы, и MK-3475 (ламбролизумаб) компании «Merck&Co.» для лечения неоперабельной и метастазирующей меланомы. По данным компании «EvaluatePharma», ожидается, что доход от продаж данных продуктов к 2018 г. может достигнуть 3,92 и 1,65 млрд дол. США соответственно.
Anoro Ellipta (умеклидиниума бромид + вилантерол) компании «GlaxoSmithKline» и «Theravance»
Несмотря на то что препарат Anoro Ellipta одобрен Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) еще в декабре 2013 г., маркетирование данного средства запланировано на I кв. 2014 г. Препарат Anoro Ellipta рекомендован в качестве поддерживающей терапии 1 раз в сутки для лечения пациентов с хронической обструктивной болезнью легких (ХОБЛ).
Профиль безопасности и эффективность данного лекарственного средства доказаны в ходе клинического исследования, в котором приняли участие более 2400 пациентов с диагнозом ХОБЛ.
По данным компании «EvaluatePharma», объем продаж Anoro Ellipta к 2018 г. достигнет 1,74 млрд дол., в свою очередь, в 2014 г. объем продаж данного препарата составит 231 млн дол.
Brintellix (вортиоксетин) компаний «Takeda Pharmaceutical» и «Lundbeck»
Препарат Brintellix одобрен FDA в 2013 г., однако его лонч планируется на 2014 г. Данное лекарственное средство применяется при депрессии у взрослых. Оценку эффективности и профиля безопасности Brintellix проводили в ходе основной программы клинической разработки, включавшей краткосрочные 6–8-месячные исследования.
В декабре 2013 г. препарат Brintellix также одобрен Европейским агентством по лекарственным средствам (European Medicines Agency — EMA). Основой для его одобрения стали результаты 12 плацебо-контролируемых клинических исследований с участием около 4 тыс. пациентов с депрессивными эпизодами тяжелой степени.
В 9 из 12 исследований препарат Brintellix продемонстрировал статистически значимые и клинически релевантные эффекты при депрессии по сравнению с плацебо. Кроме того, эффективность Brintellix доказана у пациентов с депрессивными эпизодами тяжелой степени, у которых ранее не был получен положительный ответ на лечение селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина — норадреналина.
По данным компании «EvaluatePharma», объем продаж Brintellix в 2014 г. достигнет 270 млн дол., однако уже к 2018 г. ожидается повышение данного показателя до 1,44 млрд дол.
Апремиласт компании «Celgene»
Компания «Celgene» подала заявку на одобрение кандидата в препараты апремиласт в FDA в качестве лекарственного средства для лечения псориатического артрита в І кв. 2013 г. Апремиласт представляет собой пероральный низкомолекулярный ингибитор фермента фосфодиэстераза-4 (PDE-4).
Компания «Celgene» представила положительные результаты III фазы клинических исследований апремиласта. В исследовании приняли участие 844 пациента, рандомизированных на 2 группы: 1-я группа получала плацебо, 2-я — апремиласт. На 16-й неделе лечения 50% улучшение по индексу тяжести поражения псориазом отмечено у 59% пациентов, принимавших апремиласт, в группе плацебо данный эффект достигнут только у 17%. Также исследователи отметили 75% уменьшение выраженности симптомов заболевания у 33% участников, получавших апремиласт, и у 5% пациентов из группы плацебо.
По данным компании «EvaluatePharma», объем продаж данного кандидата в препараты к 2018 г. достигнет отметки в 1,22 млрд дол.
RLX030 (серелаксин) компании «Novartis Pharmaceuticals»
В июне 2013 г. компания «Novartis Pharmaceuticals» сообщила о том, что FDA предоставило кандидату в биологические препараты RLX030 (серелаксин), рекомбинантный гормон релаксин 2, статус лекарственного средства для лечения пациентов с острой сердечной недостаточностью.
Эффективность и профиль безопасности серелаксина оценивали в ходе клинического исследования III фазы RELAX-AHF. Его результаты свидетельствуют о 37% снижении уровня смертности у пациентов, принимавших серелаксин, в течение 6 мес после развития острой сердечной недостаточности по сравнению с теми, кого лечили традиционными методами.
В случае одобрения серелаксина в 2014 г., по данным компании «EvaluatePharma», его объем продаж к 2018 г. может достигнуть 900 млн дол.
Дулаглутид компании «Eli Lilly»
В апреле 2013 г. компания «Eli Lilly» сообщила о том, что получены положительные данные 2 дополнительных клинических исследований AWARD III фазы кандидата в биологические препараты длительного действия дулаглутида, предназначенного для лечения сахарного диабета II типа.
Дулаглутид представляет собой инъекционный агонист рецепторов глюкагоноподобного пептида-1 длительного действия. Он стимулирует выработку инсулина после приема пищи и замедляет всасывание в желудочно-кишечном тракте.
Для оценки эффективности и профиля безопасности дулаглутида проведено 6 клинических исследований. В 3 клинических исследованиях зафиксировано снижение уровня гликозилированного гемоглобина А1с (НbА1с) у пациентов, которым назначался дулаглутид в дозе 1,5 мг.
По данным компании «EvaluatePharma», объем продаж дулаглутида после его одобрения FDA к 2018 г. достигнет 840 млн дол. Компания «Eli Lilly» возлагает на этот препарат большие надежды и делает все возможное для того, чтобы он был одобрен в 2014 г.
Эмпаглифлозин компаний «Boehringer Ingelheim» и «Eli Lilly»
В 2013 г. компании «Boehringer Ingelheim» и «Eli Lilly» объявили о получении положительных результатов клинических исследований III фазы кандидата в препараты эмпаглифлозина, который представляет собой ингибитор натрий-глюкоза ко-транспортера 2.
Первичных конечных точек достигли все 4 клинических исследования III фазы. У пациентов с сахарным диабетом II типа, принимавших эмпаглифлозин в дозе 10 и 25 мг 1 раз в сутки, отмечены значительные изменения уровня гликозилированного гемоглобина по сравнению с получавшими плацебо.
В случае одобрения эмпаглифлозин сможет стать эффективным средством, которое поможет контролировать уровень глюкозы в крови и достичь целей лечения.
По данным компании «EvaluatePharma», объем продаж эмпаглифлозина, в случае одобрения, может достичь к 2018 г. 770 млн дол.
Афрезза компании «MannKind»
По данным компании компании «MannKind», афрезза достиг всех первичных конечных точек в 2 клинических исследованиях III фазы. Данный кандидат в биологические препараты для проведения инсулинотерапии с использованием ингалятора под названием Дримбоут, также разработанного компанией.
В ходе двойного слепого плацебо-контролируемого исследования, применение афрезза позволило добиться снижения уровня гликозилированного гемоглобина НbА1с в крови пациентов с сахарным диабетом ІІ типа, а также изменения амплитуды колебаний уровня глюкозы в крови пациентов после приема пищи.
В ходе другого открытого исследования с участием 518 пациентов с сахарным диабетом І типа, получавших базис-болюсную инсулинотерапию (терапия многократными инъекциями инсулина), выявлены менее выраженная гипогликемия и снижение уровня глюкозы в крови натощак.
По данным компании «EvaluatePharma», объем продаж афрезза, после его одобрения FDA, может достичь к 2018 г. 730 млн дол.
Элоктат компании «Biogen Idec»
Фармацевтическая компания «Biogen Idec», занимающаяся разработкой и коммерциализацией препаратов для лечения нейродегенеративных заболеваний, гемофилии и аутоиммунных заболеваний, в мае 2013 г. объявила о том, что FDA приняло ее заявку на одобрение кандидата в биологические препараты элоктат (recombinant factor VIII Fc fusion protein) для лечения гемофилии типа A.
Заявка на одобрение элоктата базируется на результатах клинического исследования III фазы A-LONG с участием пациентов с гемофилией типа A. Результаты свидетельствуют, что у пациентов, которым вводили элоктат 1 и 2 раза в неделю, уменьшилось количество кровотечений.
В случае одобрения кандидата в биологические препараты элоктат, по данным компании «EvaluatePharma», объем его продаж может достичь к 2018 г. 690 млн дол.
IMC-1121B (рамуцирумаб) компании «Eli Lilly»
После подачи заявки на одобрение кандидата в биологические препараты IMC-1121B (рамуцирумаб) компании «Eli Lilly», предназначенного для лечения рака желудка, прогрессирующего после первой линии химиотерапии, FDA предоставило ему статус приоритетного рассмотрения.
Компания предоставила информацию о том, что в III фазе клинических исследований рамуцирумаба определены возможности данного средства относительно ингибирования функций различных белков, вовлеченных в развитие опухоли, что повышает выживаемость пациентов с раком желудка.
Рамуцирумаб представляет собой антитела, мишенью которых являются рецепторы фактора роста эндотелия сосудов (VEGFR-2).
В исследовании приняли участие 355 пациентов с прогрессирующей формой рака желудка, из них 238 больных принимали рамуцирумаб, 117 — плацебо. Все пациенты также получали поддерживающую терапию. Результаты эксперимента показали, что средняя выживаемость больных, принимавших рамуцирумаб, повысилась, а также снизился риск прогрессирования данной онкопатологии. Спустя полгода после терапии рамуцирумабом выживаемость пациентов в экспериментальной группе составила 40%, тогда как этот показатель при стандартной терапии оказался заметно ниже — всего 20%.
По данным компании «EvaluatePharma», после одобрения FDA объем продаж рамуцирумаба к 2018 г. достигнет 680 млн дол.
LY2963016 компаний «Eli Lilly» и «Boehringer Ingelheim»
В 2013 г. компании «Eli Lilly» и «Boehringer Ingelheim» объявили о том, что FDA приняло на рассмотрение их заявку на одобрение LY2963016, который является биосимиляром препарата Lantus (инсулин гларгин) компании «Sanofi». Данный кандидат в препараты — инсулин длительного действия, показанный для лечения сахарного диабета І и ІІ типов.
Заявка на одобрение LY2963016 содержит данные сравнительных фармакокинетических и фармакодинамических исследований, а также результаты клинических исследований III фазы, которые проведены у пациентов с сахарным диабетом І и ІІ типов с применением одобренного инсулина гларгина в качестве референтного препарата.
ЕМА также приняла заявку на рассмотрение для одобрения LY2963016 в июле 2013 г.
По данным компании «EvaluatePharma», объем продаж данного препарата после его лонча может достичь к 2018 г. 650 млн дол.
P.S.
Итак, в 2014 г. ожидается лонч нескольких лекарственных средств, претендующих на статус блокбастеров к 2018 г. Это препараты Anoro Ellipta — для лечения ХОБЛ и Brintellix — для лечения депрессии, а также кандидат в препараты апремиласт для терапии псориатического артрита.
Большие надежды возлагаются и на кандидатов в препараты ниволумаб и MK-3475 (ламбролизумаб). Так, компании-производители делают все возможное, чтобы ускорить выведение на рынок этих средств для лечения онкопатологии.
Стоит отметить, что в 2014 г. из топ-10 самых успешных лончей планируется лонч 6 кандидатов в препараты биотехнологической сферы, среди которых RLX030 (серелаксин) — для лечения острой сердечной недостаточности; дулаглутид, афрезза и LY2963016 — для терапии сахарного диабета; элоктат — для лечения гемофилии типа А; IMC-1121B (рамуцирумаб) — для терапии рака желудка.
Следует обратить внимание на то, что наиболее популярным терапевтическим направлением является противодиабетическое, поскольку в 2014 г. ожидается лонч 4 из топ-10 кандидатов в препараты этой группы.
По материалам http://www.evaluategroup.com, http://www.ema.europa.eu, http://www.fda.gov, http://www.lilly.com, http://www.biogenidec.com, http://www.celgene.com, http://www.novartis.com, http://www.mannkindcorp.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим