 Новий Перелік налічує 513 торговельних назв лікарських засобів (без урахування дозування та кількості в упаковці), в той час як у попередньому переліку їх містилося 229. Аналізуючи вплив цих переліків на фармацевтичний ринок, варто відзначити, що загалом у 2022 р. на роздрібному ринку України реалізовувалося 3634 SKU (Stock Keeping Unit — одиниць товарного обліку) безрецептурних лікарських засобів, у тому числі 221 SKU з попереднього переліку (наказ МОЗ № 876) та 536 — з нового Переліку (наказ МОЗ № 1295).
Новий Перелік налічує 513 торговельних назв лікарських засобів (без урахування дозування та кількості в упаковці), в той час як у попередньому переліку їх містилося 229. Аналізуючи вплив цих переліків на фармацевтичний ринок, варто відзначити, що загалом у 2022 р. на роздрібному ринку України реалізовувалося 3634 SKU (Stock Keeping Unit — одиниць товарного обліку) безрецептурних лікарських засобів, у тому числі 221 SKU з попереднього переліку (наказ МОЗ № 876) та 536 — з нового Переліку (наказ МОЗ № 1295).
Частка аптечного продажу препаратів, включених до попереднього переліку, за підсумками 2022 р. становить 4% в упаковках, в новому Переліку їх частка зросла до 29% від загального продажу безрецептурних ліків (рис. 1). У грошовому вираженні частка аптечного продажу включених до обох переліків препаратів становить відповідно 4 та 17% (рис. 2).
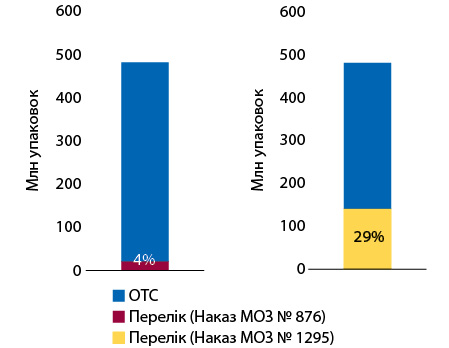
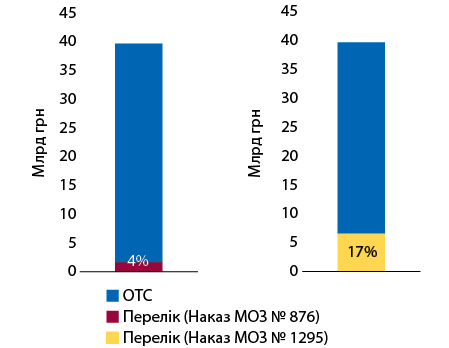
Суттєве розширення переліку препаратів та збільшення їх частки в загальних обсягах продажу ОТС-препаратів зумовлене розширенням переліку критеріїв, що застосовуються при визначенні лікарських засобів, рекламування яких заборонено, затверджених наказом МОЗ від 06.06.2012 р. № 422. У лютому 2022 р. внесено зміни до переліку критеріїв, які не переглядалися з 2012 р. Зокрема, додано критерій «Торговельна назва лікарського засобу та/або міжнародна непатентована назва (МНН) та форма випуску готового лікарського засобу така ж, як і лікарського засобу, рекламування якого заборонено».
При цьому більшість торговельних назв препаратів (270), які увійшли до нового Переліку, включені саме на підставі цього критерію.
Ще один доданий критерій — приналежність лікарського засобу до групи анатомо-терапевтично-хімічної класифікації (АТХ) за кодом J05A «Противірусні препарати прямої дії». На його підставі включено 19 препаратів.
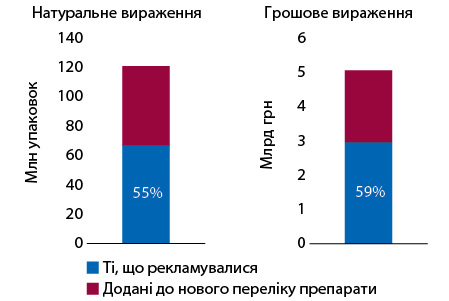
Слід відзначити, що значна частина препаратів, які включені до нового Переліку, активно рекламувалася. Якщо розглянути препарати, які увійшли до нового Переліку та не були включені в попередній, то у 2022 р. в аптеках реалізовувалося 334 SKU, з яких 82 SKU рекламувалися на телебаченні та/або радіо протягом періоду з січня 2020 до липня 2023 р. Обсяги аптечного продажу препаратів, що включені до нового Переліку та не були включені до попереднього переліку, становить 120,7 млн упаковок та 5,1 млрд грн. З них частка препаратів, що рекламувалися, становить 55% в упаковках та 59% у грошах (рис. 3).
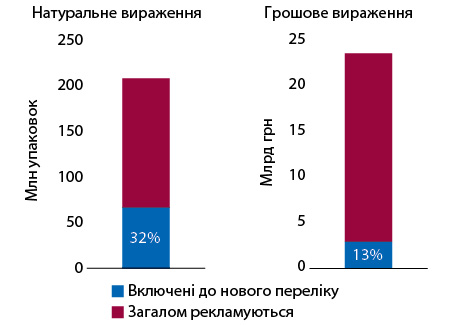
Якщо розглянути загальні обсяги продажу ОТС-препаратів, які рекламуються, то за підсумками 2022 р. обсяги аптечного продажу ліків, які рекламувалися на телебаченні та/або радіо протягом періоду з січня 2020 до липня 2023 р., становить 208 млн упаковок та 23,6 млрд грн. Частка препаратів, які рекламувалися та увійшли до нового Переліку, — 32% у натуральному та 13% у грошовому вираженні (рис. 4).
Збільшення частки аптечного продажу препаратів, які включені до нового Переліку, відбулося за рахунок включення в нього препаратів широкого споживання — ацетилсаліцилової кислоти та її комбінацій, метамізолу натрію, ксилометазоліну, парацетамолу тощо (таблиця).
| МНН | Повна назва препарату |
| Кислота ацетилсаліцилова + кофеїн + парацетамол | Цитрамон-Дарниця, Дарниця (Україна), табл. № 6 |
| Парацетамол | Парацетамол-Дарниця, Дарниця (Україна), табл. 500 мг, № 10 |
| Кислота ацетилсаліцилова + кофеїн + парацетамол | Цитрамон-Дарниця, Дарниця (Україна), табл. № 10 |
| Ксилометазолін | Евказолін® Аква, Фармак, (Україна), спрей назал. 1 мг/г, фл. 10 г |
| Ксилометазолін | Фармазолін®, Фармак (Україна), крап. назал. 0,1%, фл. 10 мл |
| Кислота ацетилсаліцилова + кофеїн + парацетамол | Фармадол®, Фармак (Україна), табл. № 10 |
| Кислота ацетилсаліцилова | Магнікор, Київський вітамінний завод (Україна), табл. 75 мг, № 30 |
| Кислота ацетилсаліцилова + кофеїн + парацетамол | Фармадол®, Фармак (Україна), табл. № 50 |
| Кислота ацетилсаліцилова | Аспірин Кардіо, Bayer Pharmaceuticals (Німеччина), табл. 100 мг, № 56 |
| Ксилометазолін | Тизин® Ксило, Johnson & Johnson (США), спрей назал. 0,1%, фл. 10 мл |
Новий Перелік сформовано відповідно до відомостей Державного реєстру України станом на 30 травня 2023 р. У той же час проведений нами попередній аналіз нового Переліку показав невідповідності за деякими позиціями із відомостями в Державному реєстрі.
Відповідно, постає питання щодо смислового навантаження та доцільності нового Переліку, адже Перелік ліків, заборонених до рекламування, не оновлювався більше ніж 4 роки.
Також варто відзначити дискусійність доцільності доданого в лютому 2022 р. критерію, що застосовується при визначенні лікарських засобів, рекламування яких заборонено: «Торговельна назва лікарського засобу та/або міжнародна непатентована назва (МНН) та форма випуску готового лікарського засобу така ж, як і лікарського засобу, рекламування яких заборонено».
Наразі складається така ситуація: наприклад, в одного з виробників відповідного лікарського засобу в портфелі є препарат у госпітальній упаковці, відпуск якого дозволено лише за рецептом. І через це вся група препаратів із відповідною діючою речовиною та формою випуску підпадає під цей критерій.
Тож можна зробити висновок, що ця регуляція не має жодного сенсу, адже вся інформація про дозвіл чи заборону до рекламування міститься в Державному реєстрі лікарських засобів. Тому варто залишити інформацію щодо дозволу на рекламування в Держреєстрі та не створювати чергової недолугої регуляції.
Затвердження нового Переліку заборонених до рекламування ліків, які відпускаються без рецепта, неабияк сколихнуло ринок, тож це питання буде докладно розглядатися в ході конференції «Фармбюджет 2024», яка відбудеться 13 вересня 2023 р. у Києві.
Детальніше з тематикою заходу та персоналіями ключових спікерів можна ознайомитися за .

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим