Гістамін та його роль у розвитку алергічних реакцій

Алергічні захворювання, зокрема алергічний риніт та кропив’янка, розвиваються у результаті складної взаємодії між різними видами клітин у відповідь на алергічні подразники, у процесі якої синтезується низка медіаторів запалення. Осьовим гравцем у цьому переліку є гістамін — ендогенний нейромедіатор, що синтезується в нейронах головного мозку, провідну роль якого у розвитку алергічних реакцій уперше описано у 1920 р. та експериментально підтверджено у 1937 р. разом із синтезом перших протиалергічних засобів. Гістамін викликає свої плейотропні ефекти шляхом активації 4 типів рецепторів — H1, H2, H3 та H4, розподіленими по всій центральній нервовій системі (ЦНС) (Montoro J. et al., 2011; Thangam E.B. et al., 2018; Tiligada E. et al., 2020).
Залежно від місця вивільнення гістаміну, його активність та ефекти можуть бути досить різними, такі як чхання, ринорея, свербіж носа і очей, закладеність носа при алергічному риніті або набряки, свербіж та висип при кропив’янці (Yanai K. et al., 2012).
Адекватна терапія алергічних розладів
З огляду на патогенез алергії лікування має включати застосування препаратів, що зможуть контролювати прояви, пов’язані з дією вивільненого гістаміну. Такими лікарськими засобами є антигістамінні препарати (АГП) — зворотні агоністи Н1-рецепторів (Yanai K. et al., 2012).
На сьогодні АГП представлені 2 поколіннями відповідно до їх фармакокінетичних властивостей, структурних характеристик та побічних ефектів. Їх вплив на ЦНС визначається їх здатністю проникати через гематоенцефалічний бар’єр (ГЕБ) і зв’язуватися з центральними Н1-рецепторами. Ця здатність залежить від ліпофільності та молекулярної маси (ММ) молекули препарату і спорідненості його з Р-глікопротеїном — трансмембранним транспортним білком (Montoro J. et al., 2011).
Різний ступінь проникнення крізь ГЕБ і зайнятість Н1-рецепторів у різних препаратів АГП залежать від низки факторів. Деякі потрапляють до ЦНС з кров’ю і пасивно переносяться в ендотелій ГЕБ. Однак, як субстрати P-глікопротеїну, вони активно транспортуються ретроградно до кровообігу головного мозку, і їх мінімальна кількість зв’язується з Н1-рецепторами. Проте рівень внеску P-глікопротеїну у здатність проникнення препаратів у головний мозок відрізняється залежно від хімічної структури молекули, а також низки інших показників. Варто зауважити, що в разі пасивної дифузії ступінь проникнення крізь ГЕБ тим вищий, чим нижча ММ сполуки, що пояснює різний седативний потенціал у окремих представників одного покоління препаратів (Pardridge W.M. et al., 2012; Гогунська І.В., 2024).
Зокрема, встановлено, що АГП 1-го покоління здатні проникати в тканини головного мозку приблизно в 5,5 раза більше, ніж 2-ге покоління, та займати Н1-рецептори, що знаходяться на постсинаптичних мембранах гістамінергічних нейронів по всій ЦНС, що може призводити до таких ускладнень, як зменшення тривалості фази швидкого сну, погіршення процесу навчання та зниження ефективності роботи, кардіотоксичності тощо (Гогунська І.В., 2023; Montoro J. et al., 2011).
З цієї причини першочерговою рекомендацією є застосування АГП 2-го покоління, які, на відміну від 1-го покоління, майже не проникають крізь ГЕБ, мають низький рівень спорідненості з Н1-рецепторами та є ліпофобними молекулами, що розглядаються як субстрати Р-глікопротеїну (Montoro J. et al., 2011).
Повідомляється, що пероральні АГП 2-го покоління є кращим варіантом лікування першої лінії алергічного риніту та кропив’янки. Пацієнти, які їх приймають, повідомляють про відносно незначні або легкого ступеню тяжкості побічні ефекти навіть після тривалого безперервного лікування (Yanai K. et al., 2012).
НІКСАР® — обґрунтований вибір АГП
Запорукою задоволеності осіб лікуванням, а отже, і довготривалого комплаєнсу є правильний вибір лікарського засобу — із найбільш сприятливим клінічним профілем (Гогунська І.В., 2024).
Одним з представників АГП 2-го покоління є лікарський засіб біластин, що представлений на українському ринку європейським виробником ліків — компанією «БЕРЛІН-ХЕМІ» під торговельною назвою НІКСАР® та показаний для симптоматичного лікування алергічного ринокон’юнктивіту (сезонного та цілорічного), а також кропив’янки.
Біластин (рис. 1), що міститься у препараті НІКСАР®, є неседативним антагоністом гістаміну тривалої дії, високоселективним блокатором периферичних H1-рецепторів, що не зв’язується з мускариновими рецепторами.
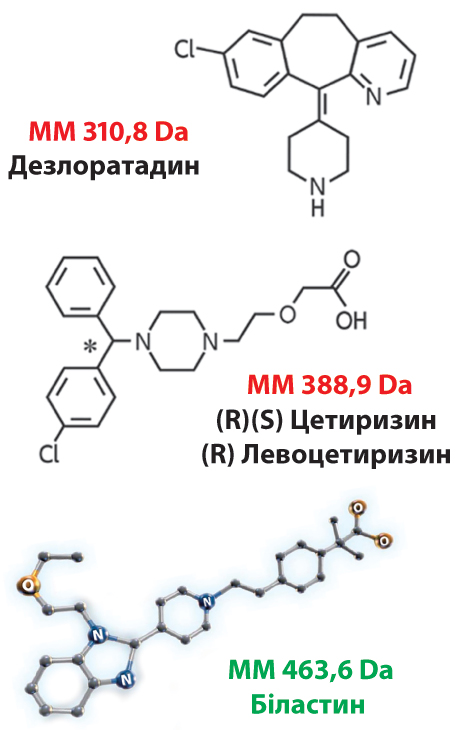
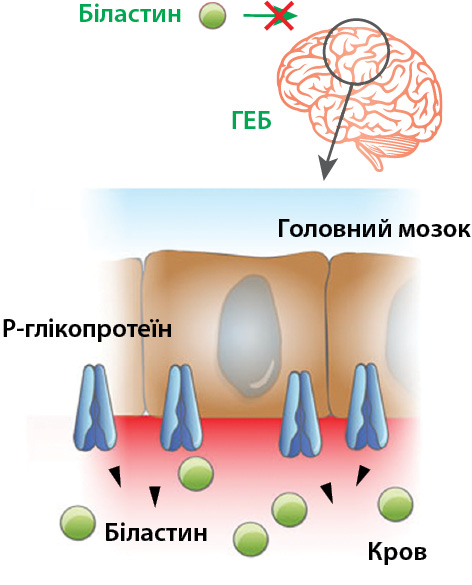
Завдяки високій спорідненості з рецепторами Н1 та великій ММ — 463,6 Da біластин не проникає через ГЕБ, отже, не взаємодіє із Н1 -рецепторами і не призводить до розвитку ймовірних побічних ефектів зі сторони ЦНС. Окрім того, цей лікарський засіб має високу спорідненість до P-глікопротеїну — особливість, характерну для 2-го покоління АГП, що збільшує бар’єр для проникнення у тканини головного мозку, тим самим зменшуючи кількість несприятливих ефектів на рівні ЦНС (Montoro J. et al., 2011) (рис. 2). Під час проведення позитронно-емісійної томографії зафіксовано, що біластин має зайнятість Н1-рецепторів головного мозку близько 0%, і тому його можна вважати «АГП, що не проникає в головний мозок» (Papadopoulos N.G. et al., 2019).
У дослідженнях встановлено, що дозування біластину при алергічному ринокон’юнктивіті та кропив’янці з огляду на клінічну ефективність та безпеку препарату має становити 20 мг/добу, адже така доза не займає Н1-рецептори та не проявляє суттєвих відмінностей при застосуванні порівняно з плацебо щодо побічних ефектів, зокрема не впливає на ЦНС. Проте навіть підвищення стандартної рекомендованої дози вдвічі є безпечним (Montoro J. et al., 2011) і добре переноситься, а також має подібний до плацебо ефект щодо розвитку сонливості й зміни частоти серцевих скорочень (Sadaba B. et al., 2013).
Баланс ефективності та безпеки біластину особливо корисний, коли для контролю симптомів потрібні дози, вищі за стандартні, як це часто трапляється у пацієнтів із кропив’янкою, яким можна вводити дози АГП, що в 4 рази перевищують стандартну дозу (Ridolo E. et al., 2015).
Варто зазначити, що біластин, наявний у складі препарату НІКСАР®, швидко всмоктується після прийому всередину і майже не проявляє взаємодії з іншими лікарськими засобами та алкоголем, оскільки суттєво не взаємодіє з ферментною системою та не піддається значному метаболізму в організмі людини (Papadopoulos N.G. et al., 2019). При його тривалому застосуванні встановлено сприятливий профіль безпеки, ефективність та переносимість (Okubo K. et al., 2017). Біластин не метаболізується ні в печінці, ні в кишечнику, не потребує коригування дози у хворих з нирковою та печінковою дисфункцією, а також у осіб літнього віку, не впливає на здатність керування транспортними засобами і різними механізмами (Гогунська І.В., 2023).
Так, під час розгляду залишкових явищ після застосування АГП на прикладі доведено, що період напіврозпаду деяких з них у головному мозку приблизно вп’ятеро довший, ніж у плазмі крові. Це спричиняє розвиток залишкових ефектів і вираженої седативної післядії, зокрема порушення циркадного циклу сну й неспання, сонливості, зниження працездатності та уваги (Гогунська І.В., 2024).
Переважна більшість застосованої дози біластину (близько 95%) виводиться в незмінному вигляді із сечею (33% ) та калом (67%), що доводить, що цей препарат практично не метаболізується в організмі та, відповідно, нівелює вірогідність розвитку залишкових побічних ефектів (Sadaba B. et al., 2013).
Біластин у складі препарату НІКСАР® відповідає сучасним експертним міжнародним Рекомендаціям щодо алергічного риніту та його впливу на астму (Allergic Rhinitis and Its Impact on Asthma — ARIA), створеним у 1999 р. на засіданні робочої групи Всесвітньої організації охорони здоров’я (ВООЗ) для лікарських засобів, які застосовують для терапії алергічних патологічних станів, зокрема алергічного риніту (Wang X.Y. et al., 2016).
У контексті вищезазначеної інформації можна наголосити, що оригінальний препарат НІКСАР® на основі біластину є саме тим правильним та обґрунтованим вибором лікарського засобу, що можна приймати при алергічному риніті та кропив’янці.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим