14 мая 2002 г. состоялась встреча руководителей ГП «Государственный фармакологический центр» МЗ Украины (ГФЦ), Государственной инспекции по контролю качества лекарственных средств Украины (ГИКК) и отечественных фармацевтических предприятий. Встреча была организована при участии Организации работодателей медицинской и микробиологической промышленности Украины (ОРММПУ). Пристутствовали заместитель государственного секретаря МЗ Украины, директор Государственного департамента по контролю за качеством, безопасностью и производством лекарственных средств (Государственного департамента) Александр Коротко, начальник отдела Кабинета Министров Украины Владимир Шпак, директор ГФЦ Александр Стефанов, первый заместитель ГИКК Украины Виталий Варченко, президент ОРММПУ Валерий Печаев.
Выступили Александр Стефанов, первый заместитель директора ГФЦ Татьяна Бухтиарова, заместитель директора ГФЦ Виктор Чумак, заведующий сектором клинических испытаний ЛС ГФЦ Владимир Мальцев, Виталий Варченко.
ПАРАДИГМА КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ-2002
|
Первым выступил Александр Стефанов с докладом «Проблема качества лекарственных средств». По мнению докладчика, значительная часть проблем в регуляции фармацевтического рынка возникает вследствие того, что отсутствуют постоянные контакты между руководителями фармацевтических компаний и представительств с представителями регуляторных органов. Поэтому руководство ГФЦ приняло решение проводить подобные встречи в первой декаде 3-го месяца каждого квартала.
Александр Стефанов отметил, что в подходе государства к регистрации ЛС можно выделить 3 периода:
I — 1992–1995 гг. Регистрирующие органы считали основной задачей наполнение отечественного рынка ЛС;
II — 1996–1999 гг. Перед регистрирующими органами стояла задача обеспечения режима максимального благоприятствования и поддержки отечественного товаропроизводителя;
III — с 2000 г. по настоящее время. Акцент деятельности регистрирующих и контролирующих органов смещается в сторону обеспечения качества ЛС, представленных на украинском рынке и соответствия украинских нормативных документов требованиям Европейского Союза (ЕС).
Понимание того, что украинские нормативные акты не вполне соответствуют таковым ЕС, пришло к отечественным регулирующим органам отнюдь не сразу и даже не вполне самостоятельно. Серьезное влияние на регулирование украинского рынка оказали зарубежные фармацевтические компании. Александр Стефанов иронически отметил, что зарубежным компаниям известны только два адреса, по которым они отправляют письма по поводу каких-либо проблем, связанных с украинским законодательством и нормативными актами, — Президента и Премьер-Министра Украины. Более того, ряд нормативных актов были приняты под прямым давлением со стороны ЕС, который обусловливал предоставление кредитов Украине именно тем, что украинские регулирующие органы исправят в украинских нормативных актах, регулирующих обращение ЛС на украинском фармацевтическом рынке, наиболее вопиющие противоречия с законодательством ЕС. С одной стороны, это требование вызвало ряд неудобств для украинских производителей фармацевтической продукции, с другой — Украина существенно продвинулась в деле гармонизации своего законодательства с законодательством ЕС и в настоящее время занимает лидирующие позиции среди стран СНГ.
Согласно Конвенции ЕС РН – 7/94 от 13.07.1994 г., директиве № 75/319 ЕЕС, рекомендациям ВОЗ PHARM 99/408, контроль качества ЛС в Украине должен осуществляться в соответствии с тремя этапами жизненного цикла ЛС: регистрация, производство, реализация. На этапе регистрации контроль качества осуществляет ГФЦ, на этапе производства — Государственный департамент, на этапе реализации — ГИКК.
Александр Стефанов подчеркнул, что в вопросе обеспечения качества ЛС следует выделить две составляющие:
1-я — свойства ЛС, обусловленные свойством самого ЛС, и заложены в него в процессе разработки и производства. Недостаточное качество в таком случае проявляется в виде как ожидаемых, так и неожидаемых побочных эффектов. Проблема сбора и систематизации данных о побочных эффектах ЛС стала решаться в Украине только в последние годы. Прошел всего 1 год с момента возникновения нормативной базы для этого процесса. В структуре ГФЦ создан отдел, который занимается такой деятельностью. Но чтобы он работал на надлежащем уровне необходимо время;
2-я составляющая зависит от нарушения технологии при производстве, хранении, распространении и реализации ЛС. Этими вопросами занимаются Государственный департамент и ГИКК. Таким образом, два потока данных о качестве ЛС в Украине до недавнего времени не были взаимосвязаны.
Руководители ГФЦ и ГИКК пришли к выводу о том, что системный подход к контролю качества ЛС позволит не только пресекать поступление на рынок некачественных препаратов но и отчасти устранить предрасполагающие к этому условия. Таковыми могут быть производство и продвижение препарата, эффективность и безопасность которого не доказана надлежащим образом; производство ЛС в условиях, которые заведомо не могут обеспечить заявленное качество; хранение и распространение ЛС в условиях, не гарантирующих сохранение их качества.
ГФЦ — это регистрирующий орган. Что касается регистрации или перерегистрации ЛС, подчеркнул Александр Стефанов, то, казалось бы, речь должна идти именно о первой составляющей. В то же время очевидно, что ряд отечественных и зарубежных производителей не могут обеспечить качество ЛС, заявленное ими в досье препарата.
В силу объективных или субъективных причин часть украинских фармацевтических предприятий не занимаются повышением качества своей продукции, другие — уделяют качеству производимых ЛС первостепенное значение. Естественно, что цена на препараты, выпускаемые последними, существенно выше. К сожалению, сейчас все больше проявляется противоречие: препараты должны быть или дешевыми, или качественными.
РЫНОК НАСЫТИЛИ ОПЕРАТОРЫ. РЕГУЛЯТОРЫ ОБЕСПЕЧАТ КАЧЕСТВО?
По данным ГФЦ, сегодня в Украине зарегистрировано 7909 лекарственных препаратов, в том числе 4974 зарубежных, 2935 — отечественных. На современном этапе, когда рынок ЛС в Украине можно считать насыщенным, задача как контролирующих, так и регистрирующих органов состоит в том, чтобы обеспечить качество препаратов, потребляемых украинскими пациентами. Именно поэтому ГФЦ и ГИКК объединили свои усилия, в результате чего были приняты приказы МЗ от 12.12.2001 г. № 497 («Еженедельник АПТЕКА», № 2 (323) от 14 января 2002 г.) и № 436 от 30.10.2001 г. («Еженедельник АПТЕКА», № 6 (327) от 11 февраля 2002 г.)
В результате ГФЦ и ГИКК получили право требовать от производителей и дистрибьюторов ЛС надлежащее их качество. Например, ГФЦ располагает возможностью подавать представление в МЗ Украины с предложением приостановить действие или аннулировать лицензию на лекарственный препарат.
Критериями применения соответствующих санкций со стороны ГФЦ могут быть: серьезные ожидаемые или неожидаемые побочные эффекты ЛС, особенно те, которые могут вызвать серьезные осложнения. Со стороны ГИКК такими критериями могут быть троекратное выявление на рынке некачественного ЛС, если речь идет о препарате для перорального применения, и однократное выявление некачественных ЛС для парентерального применения (схема 1). На самом деле это не означает, отметил Александр Стефанов, что ГФЦ начнет немедленно аннулировать регистрационные свидетельства на ЛС, но производители должны знать, что теперь регистрирующие и контролирующие органы наделены правом изымать с рынка некачественные ЛС.
Схема 1
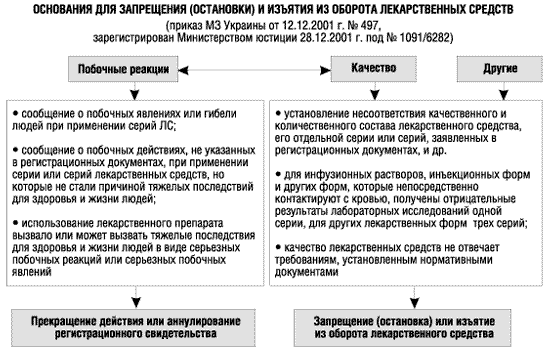 |
ПАЦИЕНТЫ НЕ ДОЛЖНЫ СОМНЕВАТЬСЯ В КАЧЕСТВЕ ПРИНИМАЕМЫХ ПРЕПАРАТОВ
Важным моментом, на который будет обращать внимание ГФЦ, является доступность необходимой информации для пациента (схемы 2—4). Согласно приказу МЗ Украины от 03.05.2001 г. № 163 («Еженедельник АПТЕКА», № 21 (292) от 28 мая 2001 г.), при регистрации и перерегистрации ЛС ГФЦ требует от заявителей подачи согласованного с ГФЦ листка-вкладыша с информацией для пациентов как неотъемлемой части регистрационного досье. На этом вопросе подробно остановилась Татьяна Бухтиарова. Согласно упомянутому приказу, внедрение листков-вкладышей должно было произойти не позднее 1 января 2002 г. Кроме того, в 2001 г. был разработан и подписан приказ МЗ Украины от 01.11.2001 г. № 442 «О дополнении приказа Министерства здравоохранения Украины от 03.05.2001 г. № 163» («Еженедельник АПТЕКА», № 46 (317) от 26 ноября 2001 г.). Внедрение листков-вкладышей для пациентов, заявил Александр Стефанов, необратимый процесс, и ГФЦ приложит все усилия, чтобы ускорить его. При этом листок-вкладыш должен быть составлен таким образом, чтобы пациент получил всю необходимую информацию, однако последняя не должна способствовать развитию ятрогенных заболеваний.
Схема 2
ИНФОРМАЦИЯ В ЛИСТКЕ-ВКЛАДЫШЕ. ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
|
Схема 3
ИНФОРМАЦИЯ, КОТОРАЯ НАНОСИТСЯ НА ПЕРВИЧНУЮ УПАКОВКУ
|
?
|
Схема 4
ИНФОРМАЦИЯ НА УПАКОВКЕ
|
|
?
|
Не менее важным вопросом является определение категорий отпуска ЛС, на чем достаточно подробно остановилась Татьяна Бухтиарова. Критерии определения таких категорий определены приказом МЗ Украины от 17.05.2001 № 185 («Еженедельник АПТЕКА», № 22 (293) от 4 июня 2001 г.) (схема 5). Кажущаяся простота этих критериев не всегда позволяет компании-производителю с достаточной степенью точности определить, в какую из названных групп попадет регистрируемый препарат. Поэтому в настоящее время, как и в 1997 г., готовятся списки рецептурных и безрецептурных ЛС, которые будут сформированы с указанием их торговых названий.
Схема 5
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ОТПУСКАЕМЫЕ ПО РЕЦЕПТУ
|
СОТРУДНИЧЕСТВО В РАМКАХ СНГ
|
МЗ Украины активно сотрудничает со странами СНГ в рамках Межгосударственной комиссии по стандартизации, регистрации и контролю качества ЛС, изделий медицинского назначения и медицинской техники государств — участников СНГ (Межгосударственной комиссии). Поскольку внутренний фармацевтический рынок многих стран СНГ достаточно ограничен, Межгосударственная комиссия в 2001 г. приняла решение рекомендовать министрам здравоохранения стран СНГ принять решение о том, чтобы разрешить маркировку ЛС, поставляемых на рынок стран СНГ, на двух языках — русском и национальном. Таким образом, фармацевтические предприятия стран СНГ получили возможность не менять технологию производства упаковки ЛС, предназначенных для внутреннего рынка и для рынка стран СНГ. Это способствовало решению вопроса о языке маркировки ЛС в Украине.
Сейчас обсуждается вопрос о стандартном для стран СНГ подходе к отнесению ЛС к рецептурным или безрецептурным.
Украина активно участвует в работе Межгосударственной комиссии. В подтверждение этого Александр Стефанов сообщил, что пособие «Руководство по клиническим испытаниям лекарственных средств», разработанное и изданное в Украине под руководством Владимира Мальцева, рекомендовано в странах СНГ в качестве учебного пособия для специалистов в области клинических испытаний ЛС.
30 мая 2002 г. в Нижнем Новгороде на очередном заседании Межгосударственной комиссии вновь встретятся представители стран СНГ и вновь будут обсуждать действия, которые национальные регулирующие органы должны предпринять для того, чтобы различия в законодательстве стран СНГ не были препятствием для экспорта и импорта ЛС в наших странах.
НЕКОТОРЫЕ ЗАДАЧИ, КОТОРЫЕ СТОЯТ ПЕРЕД РЕГУЛЯТОРНЫМИ ОРГАНАМИ УКРАИНЫ
Одной из первоочередных задач ГФЦ считает внедрение такой формы регистрационного свидетельства, при которой изменения в регистрационном досье и перерегистрация препарата не требовали изменения регистрационного номера ЛС. Однако на этом пути существует ряд препятствий технического характера. Очередной проблемой является положение о «лекарствах-сиротах», которое сейчас находится в стадии разработки. Такие решения, отметил Александр Стефанов, должны претворяться в жизнь согласно постановлениям правительства.
ВОПРОСЫ И ОТВЕТЫ
По окончанию встречи Александр Стефанов ответил на ряд вопросов присутствующих.
Директор «Борщаговского ХФЗ» Людмила Безпалько отметила, что в свое время фармацевтические предприятия Украины вложили немалые деньги, чтобы зарегистрировать свои препараты. Как теперь выяснилось, эти средства были израсходованы на внедрение морально устаревших технологий, о чем украинские регистрирующие органы, обладающие немалым научным потенциалом, не проинформировали заявителей.
Вопрос Людмилы Безпалько: Когда же отечественная фармацевтическая наука сможет предложить украинским предприятиям современные ЛС или хотя бы предостеречь от применения устаревших технологий?
Александр Стефанов достаточно обстоятельно ответил, что ни в одной стране мира государство не вкладывает деньги в развитие фармацевтической науки, а все научные исследования в этой области проводятся исключительно за счет фармацевтических корпораций. Следовательно, подобные советы и рекомендации отечественные ученые смогут давать только тогда, когда украинские предприятия начнут вкладывать деньги в работу конкретных ученых.
Вопрос: Будут ли внедряться предрегистрационный контроль и инспектирование предприятий?
Александр Стефанов разъяснил, что в данном случае необходимо избежать двух крайностей: полностью игнорировать предрегистрационную инспекцию предприятий или задаться целью проконтролировать на предприятии все. В настоящее время этот вопрос находится в стадии разработки и со временем такой контроль будет внедрен.
Вопрос: Будет ли ГФЦ ходатайствовать перед МЗ Украины об отзыве регистрационного свидетельства некачественных лекарственных препаратов?
Александр Стефанов ответил, что такая санкция будет осуществляться, но не в ближайшее время и только в связи с нарушениями, которые представляют угрозу жизни и здоровью пациентов. Что предприятия, которые прилагают усилия для повышения качества производимых ЛС, должны быть заинтересованы в том, чтобы лоббировать создание и принятие нормативных актов, способствующих изъятию с рынка некачественных ЛС.
Доклады, посвященные клиническим испытаниям ЛС, контролю качества ЛС и проблемам их производства, будут освещены в ближайших номерах «Еженедельника АПТЕКА».
Тарас Махринский
Фото Евгения Кривши
В статье использованы слайды, представленные в докладах
Александра Стефанова
и Татьяны Бухтиаровой



Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим