На встрече руководителей украинских регуляторных органов и фармацевтических предприятий, состоявшейся 14 мая 2002 г. (см. «Еженедельник АПТЕКА», № 20 (341) от 20.05.2002 г.), прозвучали выступления, в которых их авторы призывали отечественных производителей лекарственных средств (ЛС) более ответственно отнестись к качеству выпускаемой ими продукции. Надлежащее качество ЛС может быть обеспечено только за счет соблюдения надлежащих практик (GCP, GLP, GMP, GDP) на этапах разработки, производства и распространения препарата. Созданная в Украине система посерийного контроля качества ЛС на стадии их распространения подчас вызывает нарекания. Но, как следует из выступления Виталия Варченко, первого заместителя Главного государственного инспектора Украины по контролю качества лекарственных средств, она позволяет выявить значительную часть поступающих на рынок субстандартных и фальсифицированных ЛС. Кроме того, как свидетельствуют данные, приведенные в настоящей статье, с помощью действующей системы можно выявить ряд проблем, возникающих на некоторых отечественных фармацевтических предприятиях при производстве ЛС.
Цифры, приведенные Виталием Варченко, в значительной степени характеризуют положение дел с качеством ЛС в отечественной фармацевтической промышленности. Значимость темы качества ЛС определяется тем, что за последние 3 года доля отечественных препаратов на фармацевтическом рынке Украины существенно возросла. Если в 1991–1993 гг. она составляла 20–30%, то в 2001 г. — около 45% в денежном выражении и около 70% — в упаковках, т. е. в натуральном выражении украинский фармацевтический рынок примерно на 2/3 заполнен отечественными препаратами. К сожалению, среди препаратов, которые находятся в обращении на рынке, до сих пор выявляется значительное количество субстандартных. В 2000 г. с рынка было изъято 124 серии субстандартных отечественных ЛС, в 2001 г. — 120, в I квартале 2002 г. — 47 (рис. 1). Более того, ГИКК вынуждена была принимать такие меры, как остановка производства некоторых ЛС отечественного производства. В 2001 г. было остановлено производство таких препаратов: КАЛЬЦИЯ ГЛЮКОНАТ–Дарница, раствор для инъекций, производства ЗАО «Фармацевтическая фирма «Дарница», по показателю «Описание» (нерастворимый осадок); ФТАЛАЗОЛ, таблетки по 0,5 г № 10, производства ОАО «Монфарм», в 2002 г. — ОКСОЛИНОВОЙ МАЗИ 0,25%, производства ОАО «Лубныфарм», по показателям «Описание», «рН», несоответствие лекарственной формы способу применения, указанному в инструкции по применению.
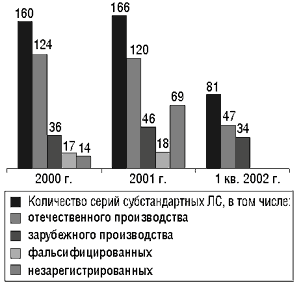 |
Рис. 1. Количество серий ЛС, оборот которых был запрещен в 2000–2002 гг.
Данные о субстандартных ЛС, выявленных региональными ГИКК (таблица), концентрируются в центре. Центральная лаборатория по контролю качества ЛС МЗ Украины (Центральная лаборатория) и другие уполномоченные лаборатории перепроверяют данные лабораторий региональных ГИКК.
Таблица
Количество выявленных в 2001 г. субстандартных ЛС лабораториями ГИКК в регионах Украины
|
Регион |
Проверено образцов ЛС |
В том числе |
Некачественные |
Процент |
|||
|
отече- |
зарубежных |
отече- |
зарубежные |
отече- |
зарубежных |
||
|
АР Крым |
1620 |
1250 |
370 |
16 |
0 |
1,28 |
0 |
|
Винницкая |
2564 |
1963 |
601 |
12 |
3 |
0,61 |
0,5 |
|
Волынская |
1279 |
924 |
355 |
4 |
13 |
0,43 |
3,66 |
|
Днепропетровская |
9337 |
3702 |
5635 |
19 |
10 |
0,51 |
1,77 |
|
Донецкая |
9174 |
4962 |
4212 |
160 |
44 |
3,22 |
1,04 |
|
Житомирская |
3337 |
2964 |
373 |
60 |
36 |
2,04 |
9,65 |
|
Закарпатская |
733 |
440 |
293 |
45 |
4 |
10,23 |
1,36 |
|
Запорожская |
1895 |
1566 |
329 |
26 |
5 |
1,66 |
1,52 |
|
Ивано- |
1742 |
1138 |
604 |
9 |
15 |
0,79 |
2,48 |
|
Киевская |
4185 |
931 |
3254 |
58 |
36 |
6,23 |
1,11 |
|
Кировоградская |
733 |
714 |
19 |
66 |
1 |
9,24 |
5,26 |
|
Луганская |
5025 |
2574 |
2451 |
48 |
88 |
1,86 |
3,59 |
|
Львовская |
2560 |
2044 |
516 |
4 |
4 |
0,2 |
0,78 |
|
Николаевская |
755 |
729 |
26 |
13 |
7 |
1,78 |
26,92 |
|
Одесская |
3450 |
2012 |
1438 |
51 |
38 |
2,53 |
2,64 |
|
Полтавская |
2203 |
2062 |
141 |
21 |
4 |
1,02 |
2,81 |
|
Ривненская |
1803 |
1656 |
147 |
99 |
27 |
5,98 |
18,37 |
|
Сумская |
1233 |
1078 |
155 |
61 |
14 |
5,66 |
9,03 |
|
Тернопольская |
1417 |
1075 |
342 |
1 |
2 |
0,09 |
0,58 |
|
Харьковская |
6835 |
4632 |
2203 |
19 |
9 |
0,41 |
0,41 |
|
Херсонская |
1884 |
1588 |
296 |
55 |
2 |
3,46 |
0,68 |
|
Хмельницкая |
1417 |
1306 |
111 |
3 |
0 |
0,23 |
0 |
|
Черкасская |
2184 |
1949 |
235 |
19 |
7 |
0,97 |
2,98 |
|
Черновицкая |
922 |
413 |
509 |
10 |
13 |
2,42 |
2,55 |
|
Черниговская |
3253 |
2816 |
437 |
32 |
3 |
1,14 |
0,69 |
|
г. Киев |
27 851 |
8874 |
18 977 |
71 |
48 |
0,8 |
0,25 |
|
г. Севастополь |
969 |
735 |
234 |
14 |
14 |
1,9 |
5,98 |
|
Украина |
100 360 |
56 097 |
44 263 |
996 |
447 |
1,78 |
1,01 |
Всего в 2001 г. Центральной лабораторией было выявлено 297 серий субстандартных ЛС отечественного производства. Чаще всего встречались несоответствия по таким показателям, как «Маркировка» (63 серии) и «Описание» (86 серий) (рис. 2). Большинство препаратов представлены в форме таблеток. Несоответствие продукции по показателю «Описание» означает, что в этих таблетках имелись вкрапления, их цвет не соответствовал АНД и т. д. Ситуация не улучшилась и в I квартале 2002 г. (рис. 3).
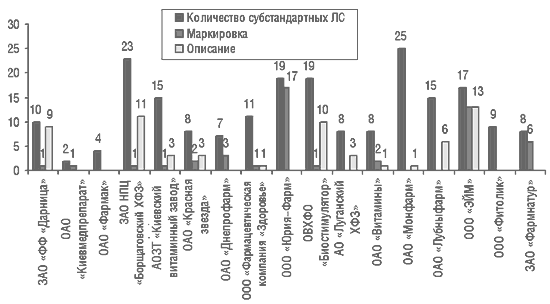 |
Рис. 2. Субстандартные ЛС отечественного производства, выявленные Центральной лабораторией ГИКК в 2001 г.
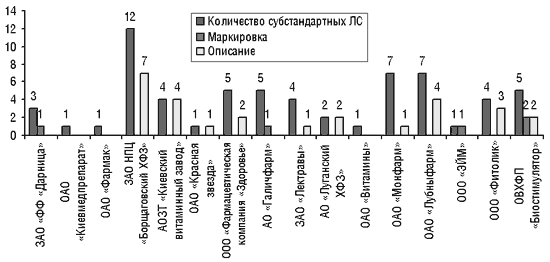 |
Рис. 3. Субстандартные ЛС отечественного производства, выявленные региональными ГИКК в I кв. 2002 г.
Еще более существенной проблемой является несоответствие ЛС АНД по фармако-технологическим показателям. Применение препаратов, не соответствующих АНД по фармакотехнологическим показателям, а также показателям «Идентификация» и «Количественное содержание», может привести к тяжелым последствиям для здоровья пациентов.
В 2001 г. ГИКК Украины и ГИКК в регионах проверено около 77 тыс. отечественных и около 65 тыс. зарубежных образцов ЛС. На рис. 4, 5 указаны показатели, по которым были забракованы ЛС.
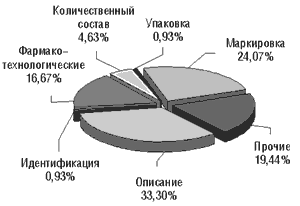 |
Рис. 4. Показатели качества, согласно которым в 2001 г. ЛС зарубежного производства не соответствовали требованиям АНД (из всех импортных ЛС, не соответствующих требованиям АНД), %
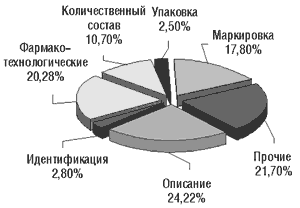 |
Рис. 5. Показатели качества, согласно которым в 2001 г. ЛС отечественного производства не соответствовали требованиям АНД (из всех отечественных ЛС, не соответствующих требованиям АНД), %
Примерно в 1% забракованных импортных препаратов не удалось идентифицировать действующее вещество, около 17% импортных препаратов не соответствовали АНД по фармакотехнологическим показателям. Количественное содержание действующих веществ примерно в 5% случаев не соответствовало АНД.
К сожалению, ситуация с отечественными ЛС еще хуже (рис. 6, 7). Не удалось идентифицировать действующее вещество в 2,8% случаев от всех забракованных отечественных препаратов, по фармакотехнологическим показателям не соответствовало АНД около 20%, количественное содержание действующих веществ не отвечало заявленным в АНД в 10,7% случаев. Таким образом, среди забракованных отечественных субстандартных ЛС около 1/3 составляют препараты, опасные для здоровья и жизни пациента.
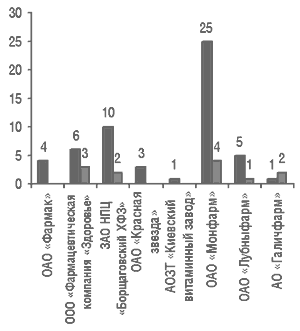 |
Рис. 6. Субстандартные ЛС отечественного производства, забракованные по фармакотехнологическим показателям, выявленные в обороте в 2001 г. (72 образца) и в I кв. 2002 г. (19 образцов)
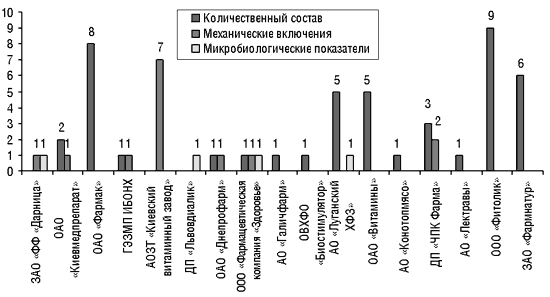 |
Рис. 7. Субстандартные ЛС отечественного производства, забракованные в 2001 г. по показателям, отклонения от которых небезопасны для здоровья человека
На территории Украины в 2002 г. были выявлены образцы трех и более субстандартных серий ЛС, архивные образцы которых при контрольных исследованиях соответствовали требованиям АНД:
-
АМИНАЛОН, таблетки, покрытые оболочкой, 0,25 г № 50, производства ЗАО НПЦ «Борщаговский ХФЗ» — 6 серий по показателю «Описание» (производство приостановлено руководством предприятия);
-
таблетки «ВИКАЛИН» № 10, производства ОАО «Монфарм» — 5 серий по показателю «Распадаемость»;
-
ДЕКАМЕВИТ®, таблетки, покрытые оболочкой, № 20, производства АОЗТ «Киевский витаминный завод» — 4 серии по показателю «Описание»;
-
БЕСАЛОЛ, таблетки № 6, производства ООО «Фармацевтическая компания «Здоровье» — 4 серии по показателю «Распадаемость» (производство приостановлено руководством предприятия).
Как отметил Виталий Варченко, результаты статистических исследований, проводимых ГИКК, свидетельствуют о том, что качество продукции фармацевтических фабрик ухудшилось до того предела, когда следует принимать серьезные решения (рис. 8, 9).
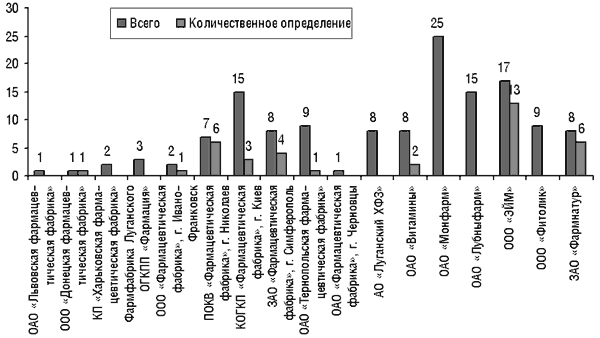 |
Рис. 8. Образцы ЛС, произведенных фармацевтическими фабриками и некоторыми фармацевтическими предприятиями, которые не соответствовали требованиям АНД согласно результатам анализов Центральной лаборатории ГИКК в 2001 г.
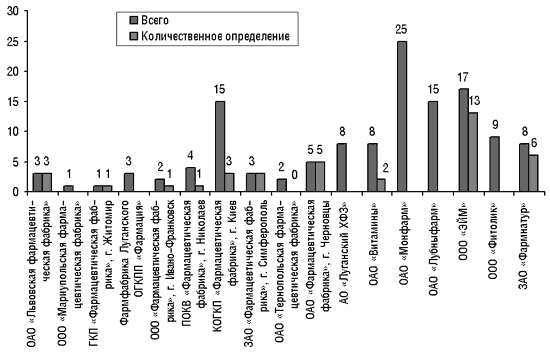 |
Рис. 9. Субстандартные ЛС, произведенные фармацевтическими фабриками и некоторыми фармацевтическими предприятиями, которые были выявлены региональными лабораториями в I кв. 2002 г.
В 2002 г. в регионах были выявлены образцы трех и более субстандартных серий ЛС, архивные образцы которых не соответствовали требованиям АНД:
-
раствор перекиси водорода 3%, флаконы по 40 мл, производства ОАО «Фармацевтическая фабрика», г. Черновцы — 5 серий по показателю «Количественное содержание перекиси водорода»;
-
перекись водорода, раствор 3%, флаконы по 25 мл, производства ЗАО «Фармацевтическая фабрика», г. Симферополь — 3 серии по показателю «Количественное содержание перекиси водорода».
По мнению Виталия Варченко, эти факты свидетельствуют не только о несоответствии условий хранения указанных выше препаратов, но и о том, что проблемы с качеством возникают еще на стадии производства и упаковки препаратов. Если в дальнейшем будут выявлены субстандартные серии указанных выше препаратов, то ГИКК будет рассматривать возможность приостановки их производства в соответствии с приказом МЗ Украины от 12.12.2001 г. № 497.
Наличие в обороте субстандартных ЛС, при том, что их контрольные образцы соответствуют требованиям АНД, может свидетельствовать о том, что на этапе распространения ЛС не создаются условия для их надлежащего хранения и транспортировки, в результате чего они могут терять свои свойства. С учетом того, что в Украине функционирует более 20 тыс. субъектов предпринимательской деятельности, которые занимаются распространением ЛС, в том числе около 18 тыс. аптек и их подразделений, в число которых входит более 1000 аптечных складов, постоянно контролировать их все весьма затруднительно. Тем не менее ГИКК регулярно ведет эту работу, и результаты проверок 236 складов в I квартале 2002 г. представлены на рис. 10.
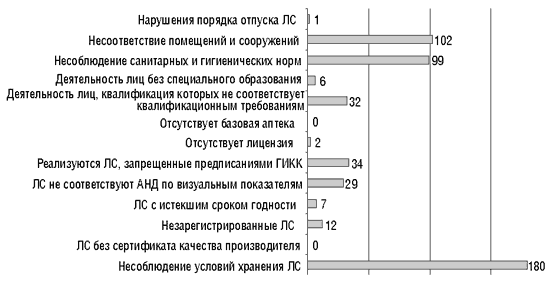 |
Рис. 10. Количество нарушений, выявленных при проверке оптовых складов ЛС в I кв. 2002 г.
Количество субстандартных серий отечественных ЛС, которые были выявлены при предварительном проведении государственного контроля в 2000 г., составило 26 (3,2%), в 2001 г. — 62 (8,8%). При этом результаты значительно отличаются в различных уполномоченных лабораториях. Если сотрудники Центральной лаборатории пришли к выводу, что из 279 проконтролированных ею серий ЛС субстандартными оказались 47 (16,8%), то в других уполномоченных лабораториях такой показатель колебался от 1,0 до 16,7%.
По-прежнему одной из проблем являются ошибки при составлении АНД, в том числе невоспроизводимость методов анализа, заложенных в АНД. Лаборатории ГИКК в 2000 г. выявили 52 АНД с невоспроизводимыми методиками, в 2001 г. — 47, в I квартале 2002 г. — 10.
В завершение выступления Виталий Варченко снова обратился к приказу МЗ Украины от 12.12.2001 г. № 497. Он отметил, что скрупулезное выполнение всех положений этого приказа позволит установить такие «правила игры» на украинском фармацевтическом рынке, которые сделают экономически невыгодным невыполнение нормативных документов и выпуск некачественных ЛС. Благодаря этому приказу создан механизм, позволяющий изымать из оборота некачественные ЛС, в том числе и в лечебных учреждениях.
По мнению Виталия Варченко, наступил момент, когда необходимо просто изымать из обращения на рынке устаревшие ЛС и в первую очередь те, качество которых не могут обеспечить отечественные производители по объективным причинам.
Тарас Махринский
В статье использованы слайды, представленные в докладе
Виталия Варченко

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим