МЕТОДОЛОГИЯ
В данном исследовании не учитывались распоряжения на запрет оборота лекарственных средств по подозрению в фальсификации, для которых невозможно оценить объем реализации. Также были исключены распоряжения на запрет оборота в связи с завершением регистрации, которые были выданы после выдачи регистрационного свидетельства. При оценке объема потребления учитывались объемы розничных продаж всех серий препаратов, вне зависимости от того, сколько серий препарата было запрещено к обороту.
ЗАПРЕТ В СВЯЗИ С ЗАВЕРШЕНИЕМ РЕГИСТРАЦИИ
В Украине, помимо регистрации, препараты подлежат перерегистрации. Данная процедура отсутствует в странах ЕС. И ее наличие в Украине влечет за собой дополнительные расходы для фармкомпаний, которые в конечном итоге сказываются на стоимости препаратов для потребителя. Кроме того, приказом МЗ Украины от 04.01.2013 г. № 3, которым вносятся изменения в приказ МЗ Украины от 26.08.2005 г. № 426 «Об утверждении Порядка проведения экспертизы регистрационных материалов на лекарственные средства, которые подаются на государственную регистрацию (перерегистрацию), а также экспертизы материалов о внесении изменений в регистрационные материалы на протяжении действия регистрационного удостоверения», усложнена процедура перерегистрации по сравнению с предыдущей редакцией, поскольку документом предусмотрено проведение лабораторных исследований, например, при внесении изменений на протяжении действия регистрационного удостоверения в спецификацию конечного продукта, методы контроля качества, даже если проведены все валидационные исследования. Поэтому на сегодня остро стоит вопрос об упрощении или полной отмене процедуры перерегистрации.
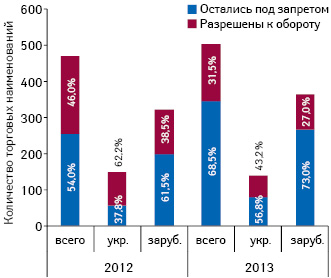
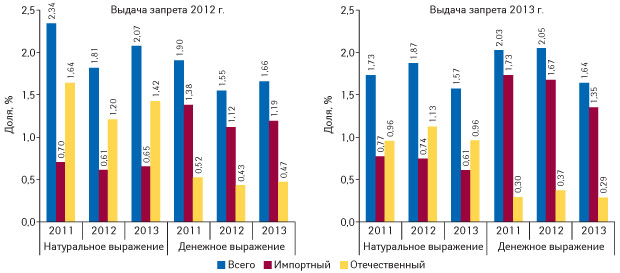
Итак, в 2012 г. в связи с окончанием срока действия регистрационного свидетельства был запрещен оборот 470 наименований лекарственных средств, из которых 216 наименований были перерегистрированы и допущены к обороту. В 2013 г. количество наименований запрещенных к обороту препаратов в связи с завершением регистрации увеличилось и составило 502 наименования. При этом допущено к обороту в связи с перерегистрацией 158 наименований (рис. 1). Следует отметить, что большая часть запрещенных препаратов — зарубежного производства. Действительно, некоторые препараты уходят с рынка и не перерегистрируются. Но, как показывает анализ, 46% препаратов, на которые был выдан запрет в 2012 г. и 31,5% запрещенных к обороту в 2013 г. все же возвращаются на рынок. При этом объем продаж препаратов, которые подпали под запрет, а позднее были допущены к обороту составляет около 2% общего объема продаж лекарственных средств как в денежном, так и в натуральном выражении (рис. 2).
ПОЛНЫЙ ЗАПРЕТ ОБОРОТА
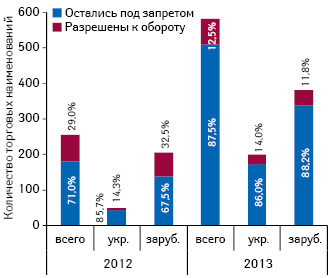
В 2012 г. количество торговых наименований препаратов, подпадающих под полный запрет оборота, составило 255 наименований, из них позднее было разрешен оборот 74 препаратов. В 2013 г. количество запрещенных препаратов увеличилось и составило 582 наименования, при том что разрешение оборота получили лишь 73 из них. При этом как в 2012, так и в 2013 г. доля зарубежных препаратов, подпадающих под полный запрет оборота, значительно выше таковой украинских препаратов (рис. 3).
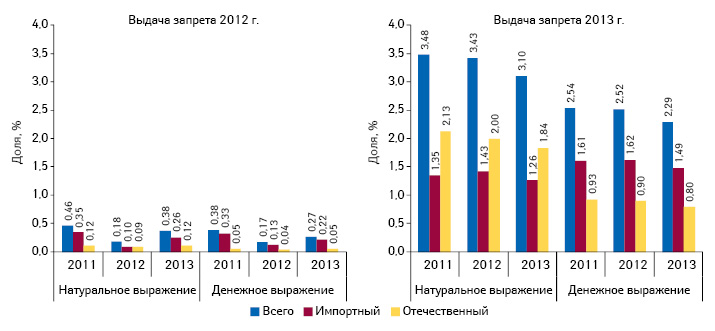
Несмотря на уменьшение количества препаратов, подпадающих под полный запрет, но впоследствии допущенных к обороту в 2013 г. по сравнению с 2012 г., объем их розничной реализации значительно выше. А их доля в общем объеме продаж лекарственных средств составляет около 3,5% в натуральном и 2,5% в денежном выражении (рис. 4).
ВРЕМЕННЫЙ ЗАПРЕТ ОБОРОТА
Под временный запрет оборота в 2012 г. подпали 1080 наименований лекарственных средств, из которых 497 впоследствии получили разрешение на обращение. В 2013 г. временно был запрещен оборот 553 наименований препаратов, из которых 195 вновь были допущены к реализации (рис. 5). В разрезе препаратов украинского и зарубежного производства, которые подпали под временный запрет оборота, также зафиксировано превалирование импортных препаратов.
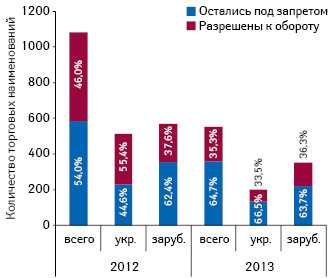
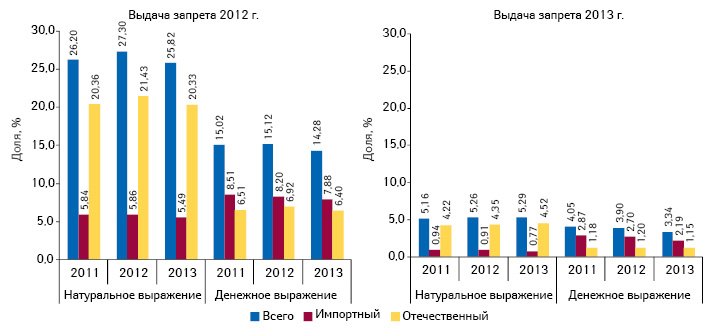
Относительно объема потребления препаратов, которые подпали под временный запрет оборота в 2012 г. и впоследствии были допущены к реализации, следует отметить, что их доля в общем объеме продаж лекарственных средств составляла более 25% в натуральном и около 15% в денежном выражении. При этом удельный вес лекарственных средств, оборот которых был временно запрещен в 2013 г. и впоследствии разрешен, существенно сократилась и составляет около 5% в натуральном и 4% в денежном выражении (рис. 6).
ИТОГИ
Как показал анализ, распоряжения о временном и полном запрете оборота препаратов, выданные Гослекслужбой, влияют на оборот достаточно весомой доли рынка лекарственных средств (рис. 7). Следует отметить, что доля препаратов, подпадающих под полный и временный запрет в 2013 г., существенно уменьшилась по сравнению с 2012 г. При этом также сократился и удельный вес препаратов, которые впоследствии были допущены к реализации.
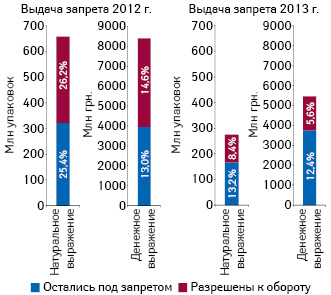
Также стоит обратить внимание, что в 2013 г. по сравнению с 2012 г. сместился акцент с выдачи распоряжений о временном запрете на полный запрет оборота.
Относительно распоряжений Гослекслужбы на запрет оборота препаратов в связи с отсутствием регистрации необходимо отметить, что следствием этих запретов является выведение из оборота около 2% всех реализуемых в Украине препаратов. Поэтому вопрос об отмене перерегистрации давно инициируется операторами рынка.
В настоящее время с целью обеспечения непрерывного доступа граждан Украины к лекарственным средствам на официальном сайте Гослекслужбы обнародован законопроект «О внесении изменений в Закон Украины«О лекарственных средствах». Данным проектом документа предлагается изложить ч. 15–16 ст. 9 упомянутого закона, которыми установлено, что в регистрационном удостоверении на лекарственное средство (удостоверение) указывается его срок действия и предусмотрена возможность его сокращения, в новой редакции. В ней предполагается, что удостоверение будет выдаваться бессрочно (аналогично торговой лицензии (marketing authorization) в странах ЕС).
Также Гослекслужба Украины предлагает разрешить свободный допуск на отечественный рынок препаратам, которые уже зарегистрированы в ЕС, а именно одобрены Европейским агентством по лекарственным средствам (European Medicines Agency — ЕМА) по централизованной процедуре.
С этой целью Гослекслужба Украины разработала проект постановления КМУ «О внесении изменений в пункт 2 Порядка государственной регистрации (перерегистрации) лекарственных средств», согласно которому в случае, если лекарственное средство уже зарегистрировано ЕМА, государственную регистрацию (перерегистрацию) такого препарата осуществляет МЗ Украины на основании поданного заявителем заявления о государственной регистрации лекарственного средства без проведения экспертизы регистрационных материалов (регистрационного досье) и контроля его качества ГП «Государственный экспертный центр МЗ Украины».

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим