Как мы уже сообщали, Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 28 мая обратилось к 5 компаниям-производителям, рекомендовав им добровольный отзыв нескольких серий препаратов метформина пролонгированного высвобождения (extended-release — ER), в которых выявлены повышенные уровни нитрозамина N-нитрозодиметиламина (NDMA).
О данной проблеме FDA стало известно из гражданской петиции, поданной частной лабораторией. Ответное письмо FDA от 28 мая в адрес петиционера — американской исследовательской аптеки Valisure опубликовано на официальном сайте. Ранее Valisure, проверяющая на качество и соответствие каждую серию продаваемых ею препаратов и диетических добавок в собственной сертифицированной согласно ISO 17025 лаборатории, поднимала вопрос о выявлении нитрозаминовых примесей в препаратах ранитидина.
Коррекция по результатам исследований
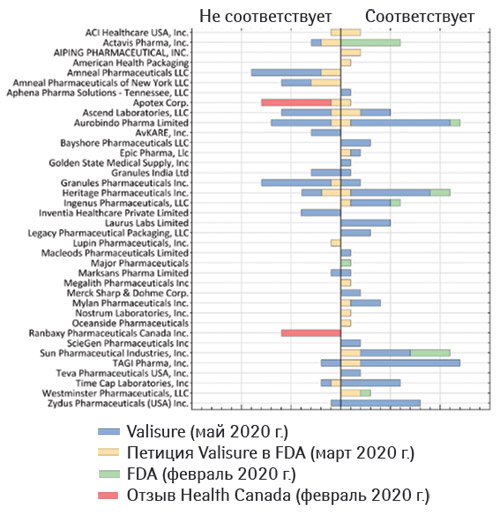
Как отмечено в письме, с 19 мая 2020 г. FDA проверило 106 образцов метформина — из приобретенных в аптеке препаратов, от собственного отдела тестирований и исследований (Office of Testing and Research — OTR) и предоставленных Valisure FDA. Протестированы препараты как немедленного, так и ER-высвобождения в дозировках 500, 750 и 1000 мг. Из 38 серий, протестированных Valisure, петицией был запрошен отзыв 16. В ходе исследований FDA установило, что только 8 серий содержат NDMA в количествах, превышающих допустимый предел потребления.
Из оставшихся 8 серий, которые петиционеры рекомендовали отозвать, 6 представляли собой препараты немедленного высвобождения и, как и остальные таблетки такого типа, согласно проведенным FDA тестам, не содержали повышенных уровней нитрозаминов. Из оставшихся 2 серий метформина ER в одной выявлены уровни NDMA ниже допустимого лимита потребления, а в другой — не выявлены вовсе.
По результатам тестирования FDA заявило: «Мы признательны Valisure за выявление данной примеси в метформине, но общее несоответствие между результатами наших тестов и результатами Valisure на тех же партиях вызывает вопросы о достоверности результатов, полученных с использованием методики Valisure по выявлению NDMA. Так, что касается 38 образцов, полученных от Valisure, в большинстве случаев результаты Valisure в 2–6 раз выше, чем у FDA для того же продукта. Во многих случаях Valisure выявлен NDMA в образцах, где тестирование FDA его не определило (ложнопозитивные результаты). В нескольких случаях FDA выявило низкие уровни NMDA, в то время как в тех же сериях Valisure не определил этого. Кроме того, ни одна из протестированных FDA серий препарата с немедленным высвобождением не содержала NDMA в поддающихся выявлению количествах. В целом эти данные свидетельствуют о том, что методология исследований Valisure на NDMA может быть ненадежной для выявления NDMA в метформине».
Отзыв
Обычно FDA рекомендует компаниям добровольно отзывать продукты, когда с ними связан риск для здоровья или нарушения действующих законов и правил. В данном случае такая просьба обращена к компаниям Actavis, Amneal, Apotex, Lupine и Marksans относительно серий метформина ER, содержащих NDMA в количествах, превышающих допустимый предел потребления, согласно анализу FDA (таблица).
| Название компании | Дозировка и форма выпуска, мг ER | № серии |
| Actavis | 750 | 1354471A |
| Amneal | 750 | AM18077A |
| 500 | AM190107AA | |
| 500 | HD03319A | |
| 500 | HM02918A | |
| Apotex | 500 | NE5801 |
| Lupin | 500 | G901203 |
| Marksans | 500 | XP9004 |
«Расследование FDA о возможности содержания в препаратах метформина NDMA в недопустимых количествах продолжаются, — отмечено в письме. — Что касается остальных запросов в вашей петиции, мы оцениваем их и ответим по завершении рассмотрения».
В сообщении, опубликованном на сайте Valisure, аптека ссылается также на решение Департамента здравоохранения Канады (Health Canada) от 5 февраля 2020 г., которым предписан отзыв по той же причине целого ряда серий (около 40) препаратов метформина 3 производителей: JAMP Pharma, Ranbaxy Pharmaceuticals Canada Inc. и Apotex Inc.
Результаты собственного исследования Valisure опубликованы до рецензирования на сайте www.medrxiv.org (Wu Q. et al., 2020), а схематическое изображение результатов тестов этой компании, Health Canada и FDA (более ранних, датированных февралем 2020 г.) представлено на сайте исследовательской аптеки (рисунок).

Коментарі