О постановке проблемы
Фальсифицированные (в том числе контрафактные) лекарственные средства — явление из сферы торгово-экономических правоотношений, актуальность которого повышается на фоне глобализации, активизации международной торговли и увеличения экономической важности интеллектуальной собственности. И хотя традиционно принято перебрасывать смысловой мостик между фальсифицированными и субстандартными лекарствами, на деле обеспечение качества лекарственных средств реализуется скорее посредством лицензирования с сопутствующими ему аудитом и инспекциями, чем борьбы с фальсификатом.
Итак, существует огромная нерешенная проблема поддельных лекарств, есть конкретная правоприменительная практика, а есть новая европейская «антифальсификатная» система, в рамках которой моделируют «тихую гавань» с гарантией определенных правил игры, которые, однако, готовы соблюдать даже не все члены Евросоюза: Греция и Италия договорились об отсрочке до 2025 г., а Франция только готовится сделать решительный шаг (последнее такое сообщение о предстоящем подключении всех 21 с лишним тысяч аптек датировано 7 февраля).
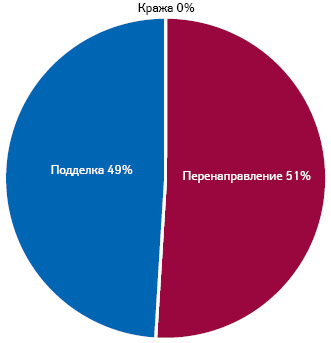
О современном масштабе описываемого явления узнаем из тематического отчета*, опубликованного в 2020 г. Так, общая стоимость контрафактной фармацевтической продукции, продаваемой во всем мире, оценивается в 4,03 млрд евро (4,4 млрд дол. США). Торговле контрафактными товарами способствует увеличение количества мелких посылок, которые сложнее выявить таможенникам. Так, в период с 2014 по 2016 г. 96% всех изъятий поддельных лекарств на таможне приходилось на почтовые или курьерские службы. В том же отчете находим результаты анализа причин арестов в связи с обвинениями в подделке лекарств (fake pharmaceuticals) за 2018 г., что, как отмечено, иллюстрирует приоритеты в правоприменительной практике стран. Итак, перенаправление (diversion) лекарств отмечали даже немного чаще, чем подделку (сounterfeiting) (рис. 1). Определение термина, которое приводят в отчете, гласит: «Незаконным перенаправлением считается незаконный перехват и продажа продукта, ранее одобренного и предназначенного для маркетинга в другой стране. Эти действия часто совершаются с помощью ложных утверждений или деклараций. Иногда регулирующие органы страны, где производится маркетинг, не одобряли использование перенаправленного лекарства. Незаконное перенаправление также может происходить в пределах одной географической зоны, страны или города. Оно включает перенаправление лекарств со скидкой от одной целевой группы потребителей к другой, приобретающей лекарства на нерегулируемом открытом рынке». В качестве примера приводят закупку правительством латино-американской страны лекарств по сниженным ценам для использования в государственных больницах с последующим перенаправлением на открытый или нелегальный рынок.
Полная прослеживаемость
Теперь немного собственно о новых реалиях. Так, упаковка большинства рецептурных (исключая гомеопатические и некоторые другие) и некоторых безрецептурных лекарственных средств (омепразол в капсулах), изготовленных и выпущенных для распространения в Европейском Союзе после 9 февраля 2019 г., в обязательном порядке должна содержать два элемента безопасности: уникальный идентификатор (двухмерный штрих-код) и средство защиты от несанкционированного вмешательства (рис. 2).
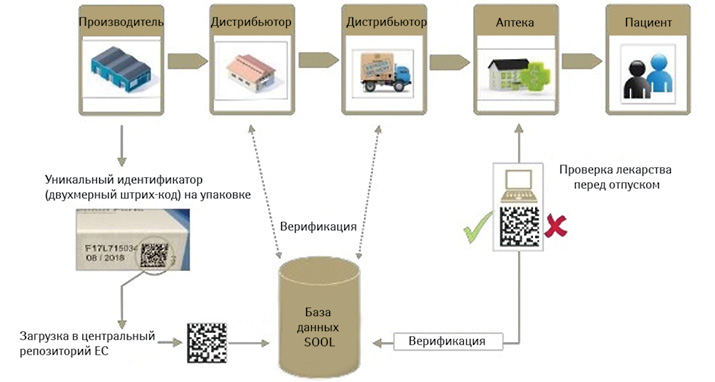
Код 2D Data Matrix, помещаемый на наружной упаковке, в закодированном виде несет 4 основных вида сведений:
1) код продукта в стандарте GTIN-EAN;
2) серийный номер упаковки;
3) номер партии;
4) срок годности.
Любой фармацевтический производитель, желающий продавать свою продукцию в ЕС, должен нанести уникальный код и механизм защиты от несанкционированного доступа на упаковку рецептурных лекарств. Каждый оптовый оператор, государственная и больничная аптеки, а также отделение больничной аптеки должны иметь индивидуальный доступ к системе, позволяющий проверять и извлекать упаковку из системы в том месте, где она была фактически доставлена.
Аптеки обязаны проверить эти меры безопасности перед отпуском лекарства покупателю. Когда аптека сканирует продукт, поддельное лекарство вызывает сообщение об ошибке, в то время как подлинная упаковка помечается как вышедшая из обращения. В обоих случаях сообщение передается из аптеки в национальную систему, которая связана с европейской центральной базой данных (см. рис. 2).
Имплементация
К сожалению, Европейская организация по проверке лекарств (European Medicines Verification Organisation — EMVO), ответственная за внедрение Европейской системы верификации лекарств (European Medicines Verification System — EMVS), по случаю 2 лет ее существования ограничилась лишь коротким поздравлением без конкретных данных. Наиболее полное их изложение удалось найти в презентации одной из партнеров и менеджеров проекта EMVO Фанни Трентезо (Fanny Trenteseaux), представленной в ходе вебинара Европейского альянса за доступ к безопасным лекарствам (European Alliance for Access to Safe Medicines — EAASM), состоявшегося 30 сентября.
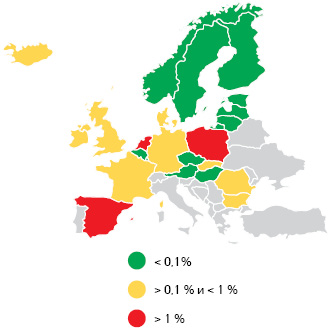
Ключевой месседж Ф. Трентезо в отчете о данном мероприятии сформулирован следующим образом: «Количество «предупреждений» (это когда при выводе упаковки из обращения система не аутентифицирует уникальную матрицу сериализованных данных на упаковке рецептов) по-прежнему сильно варьировало между странами, в 4 из них уровень предупреждений превышает 1%. Хорошей новостью является то, что общая тенденция была нисходящей по мере того, как решалось все больше и больше технических проблем». На рис. 3 представлен первый слайд с данными из презентации.
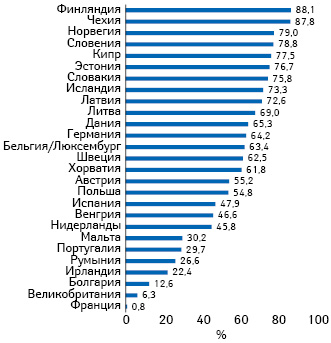
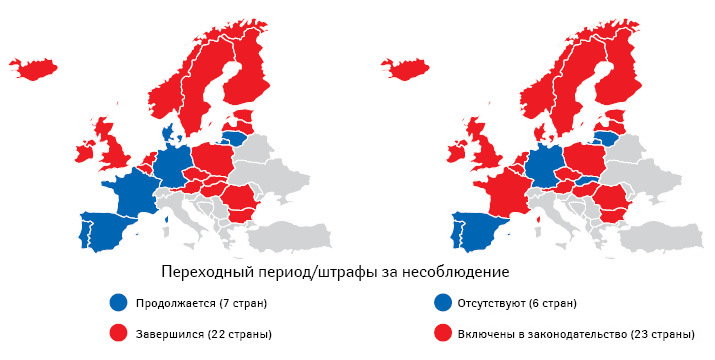
Теперь — об уровне достигнутого EMVS охвата рынка. Наиболее интересна его оценка не в отношении присоединившихся участников (дистрибьюторов, аптек и т.д.), а по доле отпущенных упаковок лекарственных средств, приходящихся на оставившие подтверждение о выведении из системы (рис. 4). Данный показатель характеризует вовлеченность в EMVS конечной части цепочки распространения — в основном аптек. Беспокойство EMVO вызывает количество неподключившихся и, особенно, — не работающих в системе. В то же время производители обеспечили практически полное отображение в системе своей продукции. При этом 22 страны считаются вышедшими из переходного периода (правда, некоторые из них все еще проходят стадии поэтапного выхода) и могут на национальном уровне привлекать нарушителей к ответственности (рис. 5).
Момент истины
Итак, не достигнув целевого показателя по частоте предупреждений (0,05%) (см. рис. 3), организаторы EMVS считают переходный период для большинства участников законченным, что влечет за собой возможность ответственности за несоответствие новым требованиям. В некоторых странах при этом продолжают действовать временные правила, согласно которым после проверки в «ручном» режиме вызвавшую срабатывание упаковку можно отпустить потребителю. В других действие подобных положений или договоренностей заканчивается. К примеру, в Словакии Государственный институт по контролю за лекарствами (Štátny ústav pre kontrolu liečiv — SLeK) сообщает, что переходный период подошел к концу 08.02.2021 г., и правила начинают действовать в полном объеме. По словам президента SLeK Ондрея Сукэша (Ondrej Sukeľ), при выявлении несоответствия во время проверки фармацевт должен отпустить другую упаковку того же препарата. «Однако при неотложной медицинской помощи и жизненной необходимости в лекарстве фармацевт имеет право отпустить пациенту упаковку препарата, отклоненную по техническим причинам».
В Чехии с 1 января 2021 г. требования Регламента ЕС 2016/61, имплементированные в национальное законодательство, необходимо исполнять в полном объеме, то есть помещать упаковку, вызвавшую предупреждение, в карантин на 14 дней до выяснения причин. Если в течение этого срока причину срабатывания установить не удалось, упаковку возвращают производителю. Ранее операторы полагались на договоренность с предыдущим министром здравоохранения, согласно которому фармацевт мог отпустить упаковку, в отношении которой получено предупреждение от системы. Своим решением, принятым на заседании 5 января, министерство, ссылаясь на «минимальное количество ошибок», более не считает оправданным «несоблюдение аптеками своих юридических обязательств». «В рамках своей стандартной инспекционной деятельности Государственный институт контроля за лекарственными средствами (Státní ústav pro kontrolu léčiv — SÚKL) будет следить за соблюдением правовых норм в этой области.
Ассоциация фармацевтов Чехии (Česká lékárnická komora — ČLnK), с неудовольствием констатируя достигнутую частоту ложных срабатываний на уровне примерно 0,07%, рекомендует: «Если как фармацевт вы вынуждены поместить лекарство в карантин вместо того, чтобы отпустить его, попробуйте объяснить пациенту, что не можете выдать лекарство, потому что оно не было проверено, и оператору грозит штраф в размере 2 млн чешских крон от SÚKL, который вместе с Минздравом настаивает на этом».
Продолжение следует…
по материалам euipo.europa.eu; emvo-medicines.eu; eaasm.eu; sukl.sk

Коментарі