Разработка проекта закона о клинических исследованиях лекарственных средств для человека является следствием необходимости обеспечить внедрение одноименного Регламента (ЕС) № 536/2014 Европейского парламента и Совета от 16 апреля 2014 г. Законопроект регулирует:
1) порядок выдачи разрешений на клиническое исследование и его существенное изменение;
2) порядок назначения, состав и задачи Главного комитета по биоэтике;
3) порядок предоставления биоэтическим комиссиям полномочий на проведение этической оценки клинических исследований;
4) принципы и процедуры проведения этической оценки клинического исследования и соответствующие сроки;
5) обязанности спонсора, главного исследователя и исследователя;
6) принципы гражданской ответственности исследователя и спонсора;
7) принципы работы Фонда защиты участников клинических исследований;
8) размер и способ оплаты вознаграждений, связанных с клиническим исследованием;
9) правила финансирования медицинских услуг, связанных с клиническим исследованием;
10) правила и порядок проведения инспекций клинического исследования.
Отличия от украинской нормативной базы
Мы проанализировали наиболее интересные, на наш взгляд, особенности польского проекта по сравнению с действующим украинским приказом. Например, в украинском нормативно-правовом акте есть понятие «клинического аудита» (в польском проекте, как и в европейском Регламенте, обозначено как «инспекция»), но инспекции — отсутствует (аудит определяют как контроль со стороны ГП «Государственный экспертный центр МЗ Украины»). Напротив, согласно польскому законопроекту, аудит проводит спонсор.
В рамках проекта вводятся правила, направленные на увеличение количества некоммерческих клинических исследований, проводимых в Республике Польша, и облегчение утверждения таких исследований.
В польском проекте исключена предусмотренная действующим законом (так же и в Украине) возможность спонсирования клинического исследования любым физическим лицом. Спонсорство разрешено лишь физическому лицу — исследователю, инициирующему некоммерческое исследование. Введено также понятие «соспонсора». Прописано также большое количество других новых положений.
Расширенное понимание
Так, аудит — независимый контроль процедур и документации клинических исследований, проводимый спонсором как элемент системы обеспечения качества с целью определения того, проводится ли клиническое исследование в соответствии с протоколом, а также данными, полученными в связи с клинисследованием, проанализированными и представленными также в соответствии с протоколом и процедурами, разработанными спонсором для стандартизации способа выполнения конкретных действий, связанных с исследованием.
В польском законе существует термин «обратная проверка изменений данных», это метод хранения документации клинического исследования, позволяющий отслеживать ход исследования и все связанные с ним события и решения.
Содержится указание на то, что финансовое вознаграждение (не считая компенсаций) может быть предложено только участникам I фазы клинического исследования — биоэквивалентности или биодоступности. Запрещается проводить клинические исследования с участием военнослужащих и других лиц, находящихся в иерархической зависимости, ограничивающей свободу информированного согласия, а также лиц, лишенных свободы или находящихся под стражей.
В документе дано определение «некоммерческого клинического исследования». Полученные в его ходе данные нельзя использовать для получения разрешения на маркетинг лекарственных препаратов, для внесения поправок в это разрешение или в маркетинговых целях, за исключением изменений в регистрационные свидетельства о безопасности лекарственных средств. Спонсору некоммерческого клинического исследования запрещается совершать правовые действия, позволяющие использовать данные, полученные в результате некоммерческого клинического исследования, для получения разрешения на маркетинг лекарственных препаратов, вносить изменения в существующее разрешение или в маркетинговых целях. В Польше потенциал некоммерческих клинических исследований используется не в полной мере, поэтому их количество все еще очень невелико. В 2011 г. было зарегистрировано всего 3 некоммерческих исследования, а в 2019 г. — 15, что составило 2,5% от общего количества (рис. 1). В некоторых странах Европейского Союза доля некоммерческих исследований достигает 40% (urpl.gov.pl).
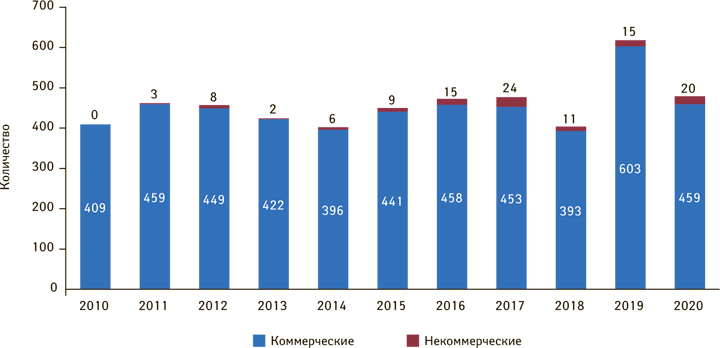
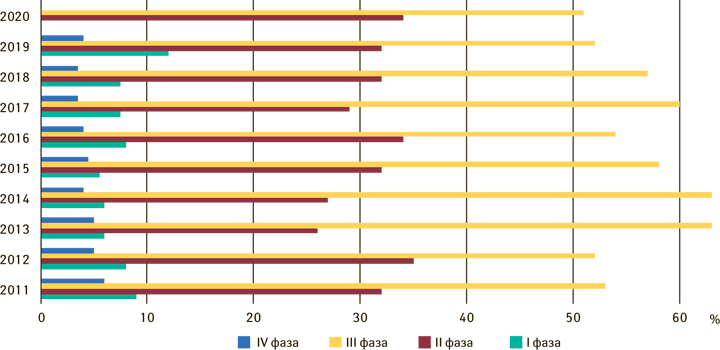
В 2020 г. в Управление регистрации лекарственных средств, медицинских изделий и биологических продуктов (Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych — URPL) было подано 597 заявок на начало клинического исследования лекарственного средства — самое большое количество за всю историю. Из них 62 заявки касались некоммерческих исследований (для сравнения, в 2019 г. —18). Среди поданных заявок преобладают таковые на клинические исследования III фазы (около 51%) и II фазы (34%) (рис. 2). Большинство (более 29%) нацелены на лекарственные средства, используемые в онкологии, 8% — для применения в педиатрии.
Главный исследователь в значении Регламента 536/2014 может иметь лицензию на практику как:
1) врач;
2) стоматолог;
3) медсестра или акушерка с высшим образованием в сестринском или акушерском деле (при этом один из исследователей может быть врачом или стоматологом).
При подаче заявки на разрешение проведения клинического исследования в Польше плата составляет (в зависимости от разновидности) от 6 до 30 тыс. злотых (от 43,5 до 218 тыс. грн). При этом еще в 2018 г., позже всех остальных стран — членов ЕС, Польша отказалась от требования предоставлять вместе с заявкой договор между спонсором и исследователем, как сейчас принято в нашей стране. Спонсор обеспечивает соответствие исследуемых препаратов нормам Надлежащей производственной практики (Good Manufacturing Practic — GMP).
Главный комитет по биоэтике
Новым законом учреждается Главный комитет по биоэтике при президенте Агентства по клиническим исследованиям (Agencja Badań Medycznych; далее — Агентство). Главный комитет по биоэтике состоит из не более чем:
1) 15 представителей по научным дисциплинам: медицинские, фармацевтические науки или науки о здоровье, с высшим образованием и степенью магистра или эквивалентной и не менее 10 годами профессионального опыта:
а) как практикующий врач, стоматолог, медсестра, лабораторный диагност, фармацевт или
б) в сфере исследований в области медицины и наук о здоровье, в частности, клинических исследований;
2) 6 представителей по научным дисциплинам: философия, богословские науки, с не менее чем 5 годами профессионального опыта в области биоэтики;
3) 6 представителей научной дисциплины «Юриспруденция» с не менее чем 3-летним опытом профессиональной деятельности, непосредственно связанной с оказанием юридической помощи в области медицинского права или подготовкой проектов нормативных актов, связанных с медицинским правом;
4) 3 представителя организаций, уставной целью которых является защита прав пациентов.
К членам главного комитета по биоэтике предъявляется ряд других требований правового характера. Член Главного комитета по биоэтике получает вознаграждение в размере, не превышающем двукратной средней величины ежемесячной заработной платы в предпринимательском секторе без учета премий из прибыли за предыдущий год, объявленной в официальном вестнике Республики Польша «Monitor Polski» за определенный месяц.
Главный комитет по биоэтике готовит этический обзор клинического исследования непосредственно или путем назначения биоэтической комиссии, принимая резолюцию преобладающими 3/4 голосов при открытом голосовании каждым членом, без возможности воздержаться.
Ответственность за ущерб
Проведение клинического исследования не освобождает исследователя и спонсора от гражданской ответственности, возникшей в результате проведенного клинисследования. Для проведения клинического исследования спонсор обязан застраховать ответственность (за причинение телесных повреждений, расстройство здоровья или смерть) перед третьими лицами, за исключением клинических исследований с низкой степенью вмешательства (это исключение не распространяется на страховку исследователя).
Министр, ответственный за финансовые дела, по согласованию с министром, отвечающим за вопросы здравоохранения, после консультации с Польской страховой палатой (Polskiej Izby Ubezpieczeń) определит в виде постановления точный объем обязательного страхования и минимальную сумму гарантий с учетом специфики клинического исследования.
Перед началом клинисследования спонсор вносит взнос в Фонд защиты участников клинических исследований (Fundusz Ochrony Uczestników Badań Klinicznych; далее — Фонд), являющийся государственным целевым фондом, управляемым Агентством. Из средств Фонда выплачивают компенсации в связи с вредом, причиненным вследствие клинических исследований.
Доходами Фонда являются:
1) вышеупомянутые взносы;
2) дотации из государственного бюджета в соответствии с годовым финансовым планом;
3) проценты на накопленные средства;
4) добровольные взносы, завещания и пожертвования;
5) прочие доходы.
Правом на получение пособия в связи с телесными повреждениями или смертью участника клинического исследования обладают также его родственники, которые могут подавать в Фонд соответствующие заявки на протяжении 1 года после того, как об этом стало известно, но не позднее 3 лет с момента окончания исследования.
Состав комиссии, члены которой имеют право на вознаграждение в размере 600 злотых за рассмотрение заявления, определяется президентом Агентства в каждом случае отдельно. В ее состав входят:
1) минимум 2 члена с уровнем магистра или его эквивалентом в области медицинских наук, которые занимаются медицинской профессией не менее 5 лет или имеют ученую степень доктора медицинских наук;
2) 1 участник, имеющий как минимум высшее образование и уровень магистра юриспруденции, работавший юристом не менее 3 лет или имеющий степень доктора юридических наук, обладающий знаниями в области клинических исследований.
Цель работы комиссии — определить, связаны ли повреждения пациента с его участием в клиническом исследовании, а также предполагаемый размер компенсации, если установлено, что ущерб причинен в результате такого участия. В ее заседаниях (уведомление о дате должно быть вручено не менее чем за 7 дней), за исключением той части, во время которой проводится обсуждение и голосование ее решения (принимают в срок до 4 мес), может участвовать лицо, подавшее заявку, а также представитель:
1) спонсора или исследователя;
2) страховой организации, с которой спонсором или исследователем заключен договор страхования ответственности.
В случае установления факта причинения ущерба вследствие участия в исследовании комиссия может указать, что ущерб причинен по вине исследователя или спонсора. В течение 14 дней после вынесения заключения заявитель, исследователь и спонсор имеют право направить президенту Фонда мотивированное ходатайство о пересмотре. Заявление о пересмотре дела рассматривают в течение 30 дней комиссией в другом составе.
Лицо, подававшее заявление на получение компенсации, в течение 7 дней с даты получения предложения о размере компенсации подает заявление о ее принятии или отклонении. Повторное обращение в связи с теми же повреждениями, что стали известны на момент подачи первого заявления, не допускается. Сумма страхового возмещения (если применяется) уменьшается на сумму компенсации (или наоборот). Последнюю выплачивают в течение 30 дней после принятия соответствующего решения. Ее максимальная величина составляет (подробные условия будут определены министром) на одного участника одного исследования в случае:
1) причинения вреда здоровью — 100 000 злотых (728 тыс. грн);
2) смерти — 300 000 злотых (2,2 млн грн).
Расходы на рассмотрение дела комиссией несут либо заявитель, либо спонсор, в зависимости от того, в чью пользу выносится решение. Так, «проигравшая» сторона оплатит величину государственной пошлины (200 злотых или около 1500 грн), возмещение расходов на проезд и проживание, а также потерянного заработка или дохода членов комиссии и вознаграждение за составление заключения.
Принципы финансирования медицинских услуг в связи с исследованием
Спонсор (если исследование некоммерческое, правила немного иные) финансирует медицинские услуги, связанные с исследованием и включенные в протокол клинического исследования, в том числе необходимые для устранения последствий побочных реакций исследуемого препарата или эффектов прочих вмешательств, выполняемых исключительно в целях клинического исследования, если они выходят за рамки гарантированного общеобязательным страхованием пакета услуг. Таким образом разграничивают обязанности спонсора и государства.
Ответственность за нарушения
Проведение клинического исследования без получения информированного согласия участника или его законного представителя, использование в исследовании стимулов или финансовых вознаграждений, или обещание улучшить здоровье в ходе клинисследования, внесение в протокол (без соответствующих согласований) изменений, имеющих значение для безопасности участников, начало исследования без необходимых разрешений, а также непредоставление информации о неожиданных серьезных побочных реакциях и отклонениях от протокола (со стороны спонсора) наказывается штрафом, ограничением либо лишением свободы на срок до 3 лет. Продолжение клинического исследования после вынесения решения о его приостановлении также предусматривает наложение штрафа.
Благодаря данной законотворческой инициативе Польша получает отдельный правовой акт, выделяющий сферу клинических исследований, поскольку ранее этому служил лишь закон о лекарствах (Prawo farmaceutyczne), гармонизированный с Директивой 2001/20/ЕС Европейского парламента и Совета.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим