 Визначення прогалин у доступі до інноваційних ліків у вибраних терапевтичних сферах у країнах Східної Європи — таке завдання ставлять перед собою розробники дослідницького проєкту «G.A.P.» (gapv4.eu). Наразі ним опікується польська аналітична компанія «HTA Consulting» у партнерстві із Європейською федерацією фармацевтичних виробників та асоціацій (European Federation of Pharmaceutical Industries and Associations — EFPIA) та Асоціацією роботодавців інноваційних фармацевтичних компаній Польщі «INFARMA».
Визначення прогалин у доступі до інноваційних ліків у вибраних терапевтичних сферах у країнах Східної Європи — таке завдання ставлять перед собою розробники дослідницького проєкту «G.A.P.» (gapv4.eu). Наразі ним опікується польська аналітична компанія «HTA Consulting» у партнерстві із Європейською федерацією фармацевтичних виробників та асоціацій (European Federation of Pharmaceutical Industries and Associations — EFPIA) та Асоціацією роботодавців інноваційних фармацевтичних компаній Польщі «INFARMA».
Різні параметри доступності
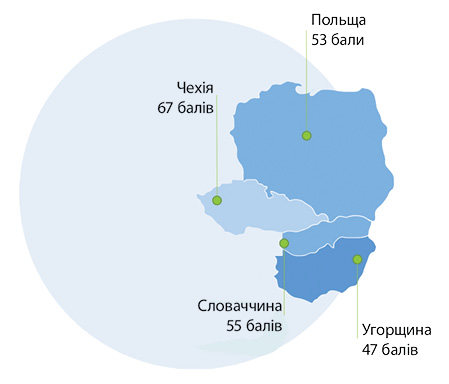
У рамках проєкту вже другий рік поспіль визначають доступність ліків у Польщі, Угорщині, Чехії та Словаччині, порівнюючи її зі стандартами медичної допомоги в якості орієнтира. Проведений аналіз дав змогу виявити певні відставання в доступності. Загалом, як свідчать результати дослідження, доступ до інноваційних ліків у названій групі країн є далеким від оптимального. Так, загальна оцінка доступності вибраних ліків є максимальною у Чехії; мінімальною — в Угорщині (рис. 1).
Для оцінювання обрано загалом 12 показань у 3 терапевтичних напрямах (табл. 1).
| Показання в різних терапевтичних напрямах | ||
| Онкологія | Рідкісні захворювання | Інші хронічні захворювання |
| Недрібноклітинний рак легені | Муковісцидоз | Цукровий діабет |
| Рак молочної залози | Гострий мієлоїдний лейкоз | Розсіяний склероз |
| Рак передміхурової залози | Лімфома | Бронхіальна астма |
| Рак яєчника | Спінальна м’язова атрофія (СМА) | Хвороба Паркінсона |
За кожним з напрямів за відповідними показаннями відібрано лікарські засоби, що отримали дозвіл на маркетинг у ЄС в період 2010–2022 рр. Їх доступність оцінено за допомогою набору із 8 індикаторів (див. табл. 2). Відповідні оцінки базуються на даних, опублікованих національними органами влади країн, включаючи бази даних відшкодування та відпущених рецептів. Крім того, як орієнтир використано міжнародні рекомендації, опубліковані професійними організаціями.
| Назва | Опис |
| Обмеження відшкодування | Частка реімбурсованих (на регулярній чи нерегулярній основі) ліків, що отримали дозвіл на маркетинг у ЄС; при цьому частковому відшкодуванню (обмеження показань порівняно із затвердженими у ЄС) надається менша вага |
| Час до відшкодування | Період (днів) між схваленням та початком відшкодування на звичайній основі |
| Відповідність міжнародним рекомендаціям | Частка в реімбурсації показань, що відповідають провідним міжнародним рекомендаціям |
| Доступність програм раннього доступу | Частка реімбурсованих ліків, охоплених відповідними програмами (за винятком надання зі співчуття) до регулярного відшкодування |
| Частка пацієнтів, які отримують інноваційні ліки | Частка тих, хто отримує інноваційний препарат, серед усіх пацієнтів з відповідними показаннями |
| Споживання | Застосування ліків з певним кодом ATC (в абсолютному значенні) на загальну кількість населення за 12 міс |
| Відшкодування молекулярних тестів | Стосується специфічних діагностичних засобів, використання яких зумовлено врахуванням певних біомаркерів згідно з інформацією про препарат (інструкцією) |
| Доступ до складної діагностики | Типовий час очікування для планової діагностики, від якої залежить призначення лікування |
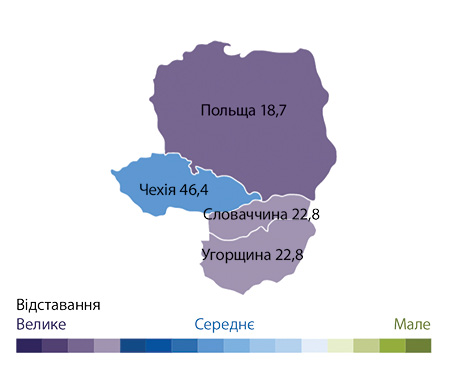
Зручний дашборд дає змогу відслідкувати значення кожного з індикаторів по кожному терапевтичному напряму в будь-якій з 4 країн. Так, найгірше становище — за індикатором № 5 (рис. 2).
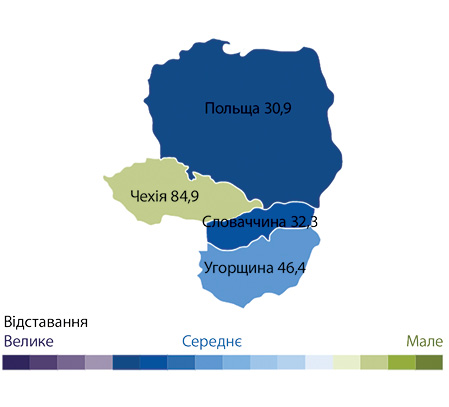
Найбільше розходження між країнами — за показником № 6 (рис. 3).
У Польщі відшкодовують лише 26% найновіших ліків
Ще один проєкт у рамках «G.A.P.» має назву Польський реімбурсаційний радар (Polski Radar Refundacyjny). На сайті представлено динамічну карту зміни з часом ситуації з відшкодуванням ліків та їх доступності в Польщі, починаючи з 2015 р. Дані представлено у вигляді динамічного звіту.
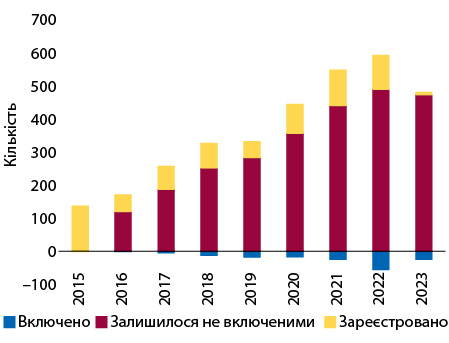
Завдяки вказаним на сайті даним також можна спостерігати за динамікою отримання інноваційними ліками дозволів на маркетинг у ЄС та включенням їх до числа відшкодовуваних у Польщі, починаючи з 2015 р. (рис. 4). За 8 років, що минули, щорічно у ЄС схвалювали в середньому по 79 лікарських засобів, а у Польщі починали відшкодовувати по 18. Тож станом на травень 2023 р. із 642 інноваційних ліків, що отримали дозвіл на маркетинг у ЄС з 2015 р., відшкодовують вартість лише 170, тобто 26%.
Найгірша ситуація в галузі інфекційних хвороб (зареєстровано 84 препарати, відшкодовують у Польщі — 5). Найкраща ситуація у сфері ревматології, де частка відшкодовуваних ліків становить 52%.
Завдяки доступності та зручному представленню подібних даних про реімбурсацію в сусідніх країнах всі зацікавлені сторони, включаючи пацієнтів, можуть отримати інформацію про поточний стан проблеми.
за матеріалами gapv4.eu; hta.pl

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим